- ドプテレット®トップ
- セミナー・講演会
- ドプテレット®について持続性及び慢性免疫性血小板減少症(ITP)
- ドプテレット®について慢性肝疾患に伴う血小板減少
- 資料ライブラリ
- 持続性及び慢性免疫性血小板減少症(ITP)
- 慢性肝疾患に伴う血小板減少
- ドプテレット製品詳細
- ドプテレット®トップ
- セミナー・講演会
- ドプテレット®について持続性及び慢性免疫性血小板減少症(ITP)
- ドプテレット®について慢性肝疾患に伴う血小板減少
- 資料ライブラリ
- 持続性及び慢性免疫性血小板減少症(ITP)
- 慢性肝疾患に伴う血小板減少
国際共同第Ⅲ相試験[E5501-G000-311試験/ADAPT-2試験]
有効性
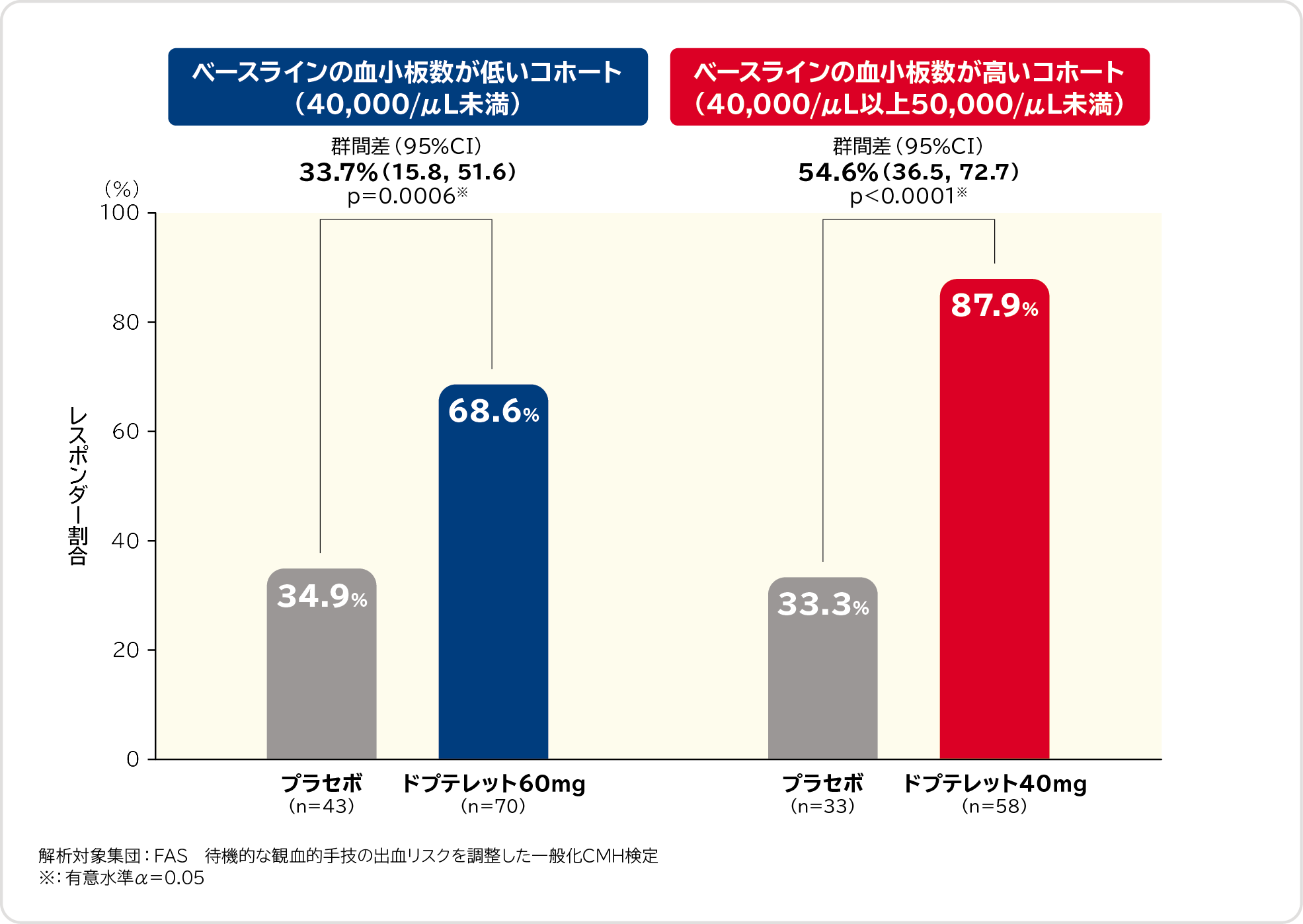
1. ランダム割り付けから待機的な観血的手技の7日後までの出血に対する血小板輸血及び止血処置を回避した被験者の割合(レスポンダー割合)〔主要評価項目〕 検証的解析結果
ベースラインの血小板数が低いコホート(40,000/μL未満)におけるレスポンダー割合は、プラセボ群34.9%、ドプテレット60mg群68.6%、群間差は33.7%(95%CI:15.8, 51.6)であり、ドプテレット60mg群ではプラセボ群に比べてレスポンダー割合が有意に高いことが示されました。
また、ベースラインの血小板数が高いコホート(40,000/μL以上50,000/μL未満)におけるレスポンダー割合は、プラセボ群33.3%、ドプテレット40mg群87.9%、群間差は54.6%(95%CI:36.5, 72.7)であり、ドプテレット40mg群でもプラセボ群に比べてレスポンダー割合が有意に高いことが示されました。
以上の結果から、レスポンダー割合におけるドプテレットのプラセボに対する優越性が検証されました。
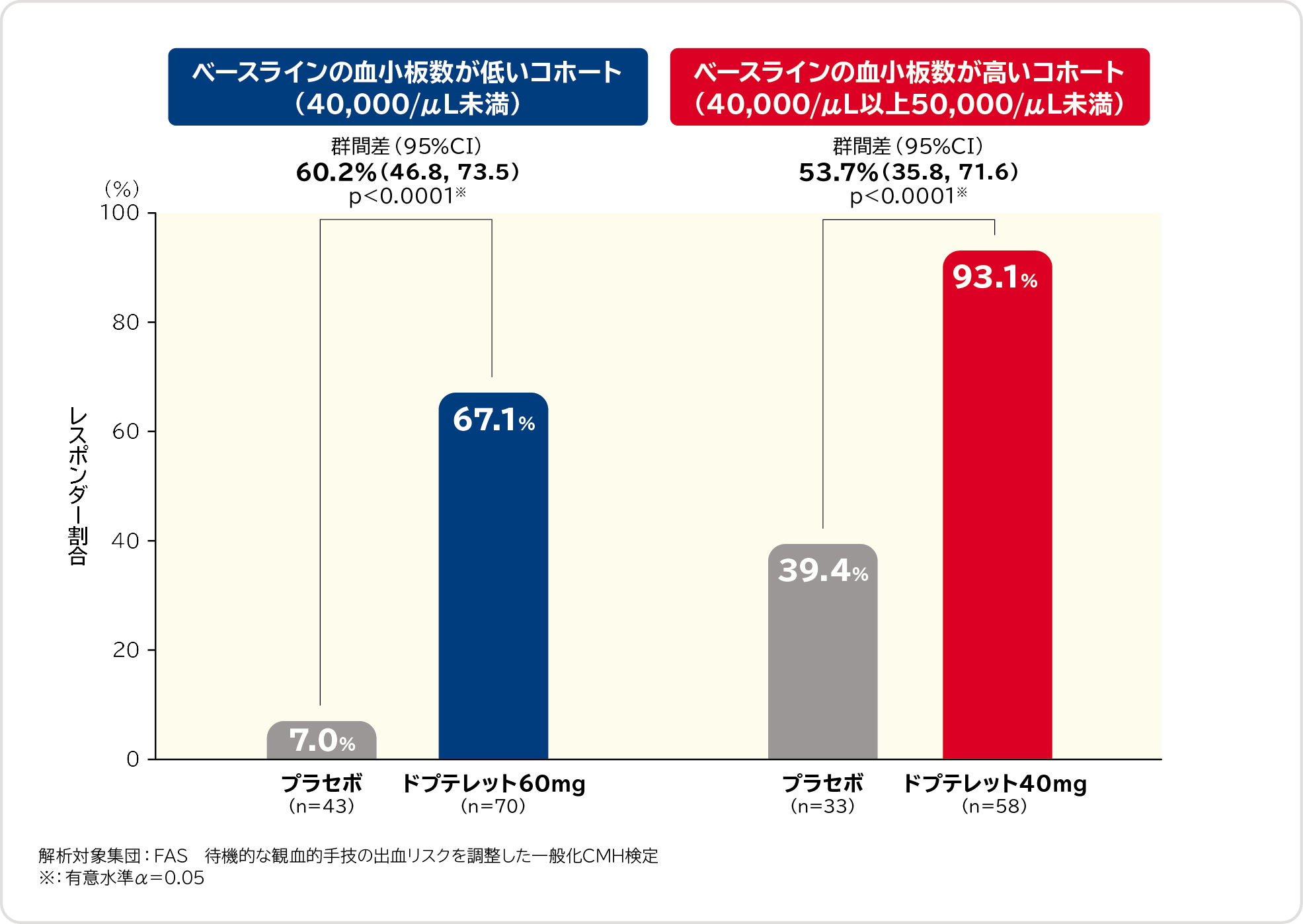
2. 待機的な観血的手技日に血小板数が目標とした50,000/μL以上に達した被験者の割合(レスポンダー割合)〔副次評価項目〕
ベースラインの血小板数が低いコホート(40,000/μL未満)におけるレスポンダー割合は、プラセボ群7.0%、ドプテレット60mg群67.1%、群間差は60.2%(95%CI:46.8, 73.5)であり、ドプテレット60mg群ではプラセボ群に比べてレスポンダー割合が有意に高かったことが示されました。
また、ベースラインの血小板数が高いコホート(40,000/μL以上50,000/μL未満)におけるレスポンダー割合は、プラセボ群39.4%、ドプテレット40mg群93.1%、群間差は53.7%(95%CI:35.8, 71.6)であり、ドプテレット40mg群でもプラセボ群に比べてレスポンダー割合が有意に高かったことが示されました。
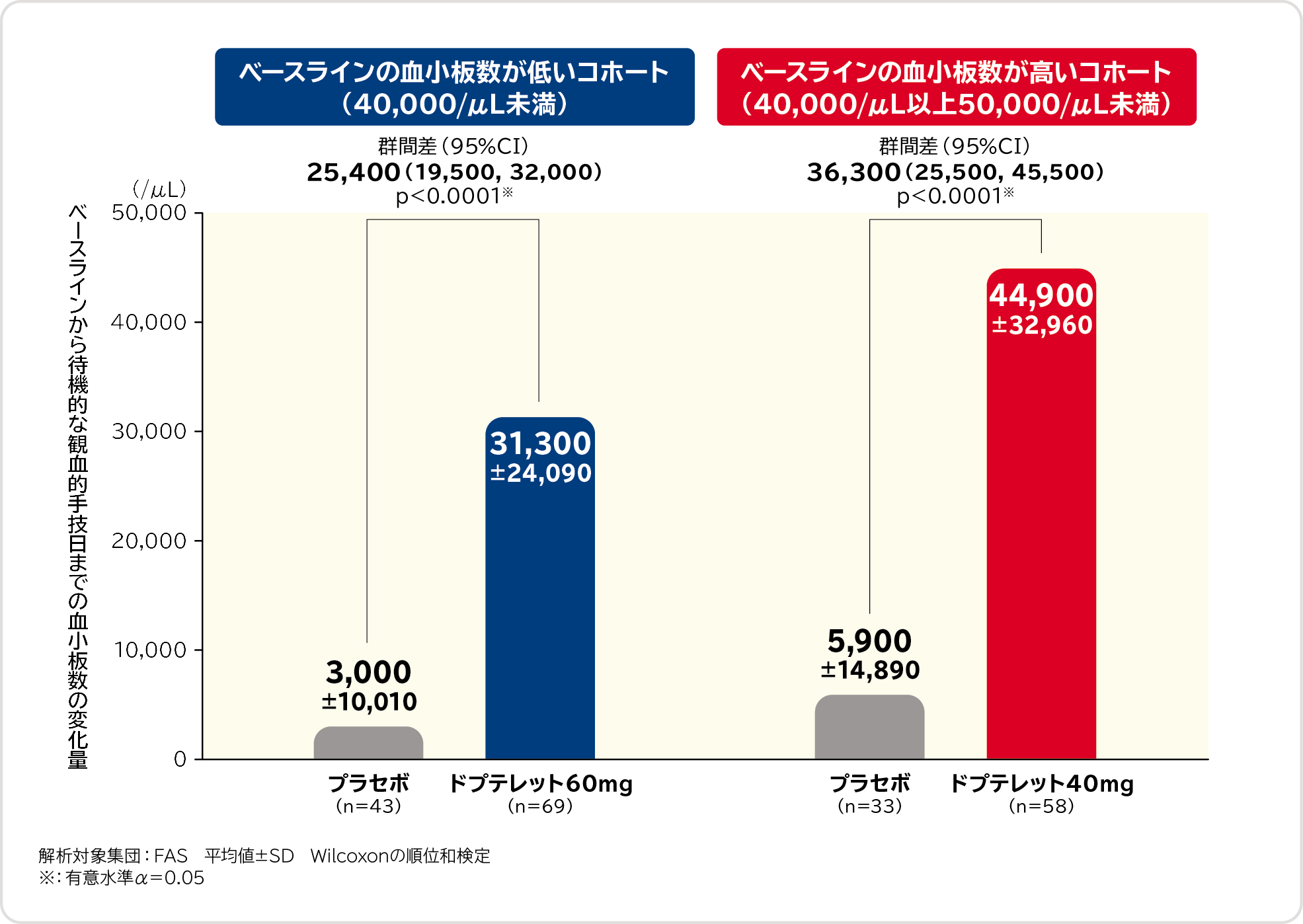
3. ベースラインから待機的な観血的手技日までの血小板数の変化量〔副次評価項目〕
ベースラインの血小板数が低いコホート(40,000/μL未満)におけるベースラインから待機的な観血的手技日までの血小板数の変化量は、プラセボ群3,000/μL、ドプテレット60mg群31,300/μL、群間差は25,400/μL(95%CI:19,500, 32,000)であり、ドプテレット60mg群ではプラセボ群に比べて血小板数の変化量が有意に大きかったことが示されました。
また、ベースラインの血小板数が高いコホート(40,000/μL以上50,000/μL未満)におけるベースラインから待機的な観血的手技日までの血小板数の変化量は、プラセボ群5,900/μL、ドプテレット40mg群44,900/μL、群間差は36,300/μL(95%CI:25,500, 45,500)であり、ドプテレット40mg群でもプラセボ群に比べて血小板数の変化量が有意に大きかったことが示されました。
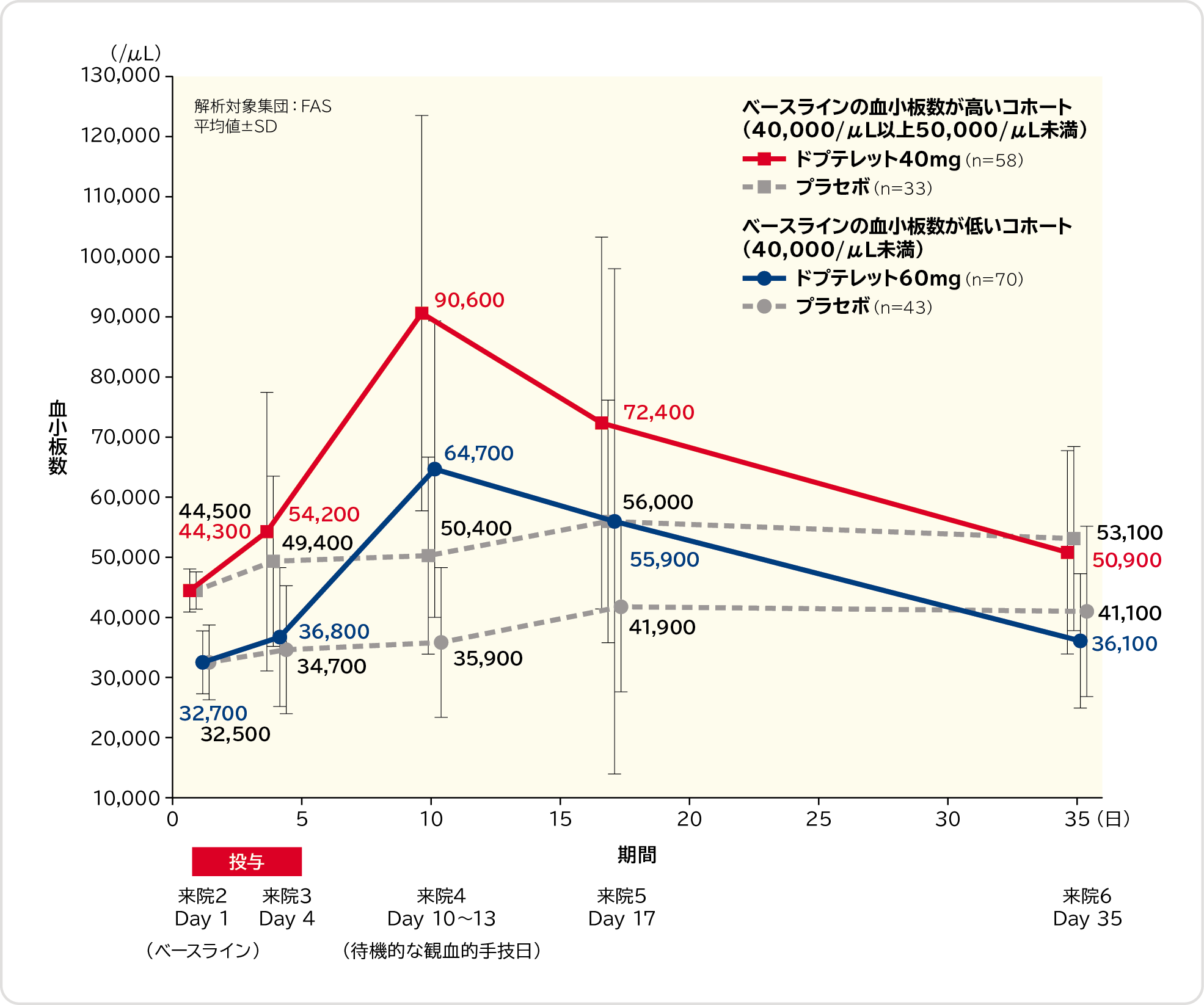
4. 各来院時での血小板数〔探索的評価項目〕
ベースラインの血小板数が低いコホート(40,000/μL未満)及びベースラインの血小板数が高いコホート(40,000/μL以上50,000/μL未満)における各来院時での血小板数の推移は以下のとおりでした。
安全性
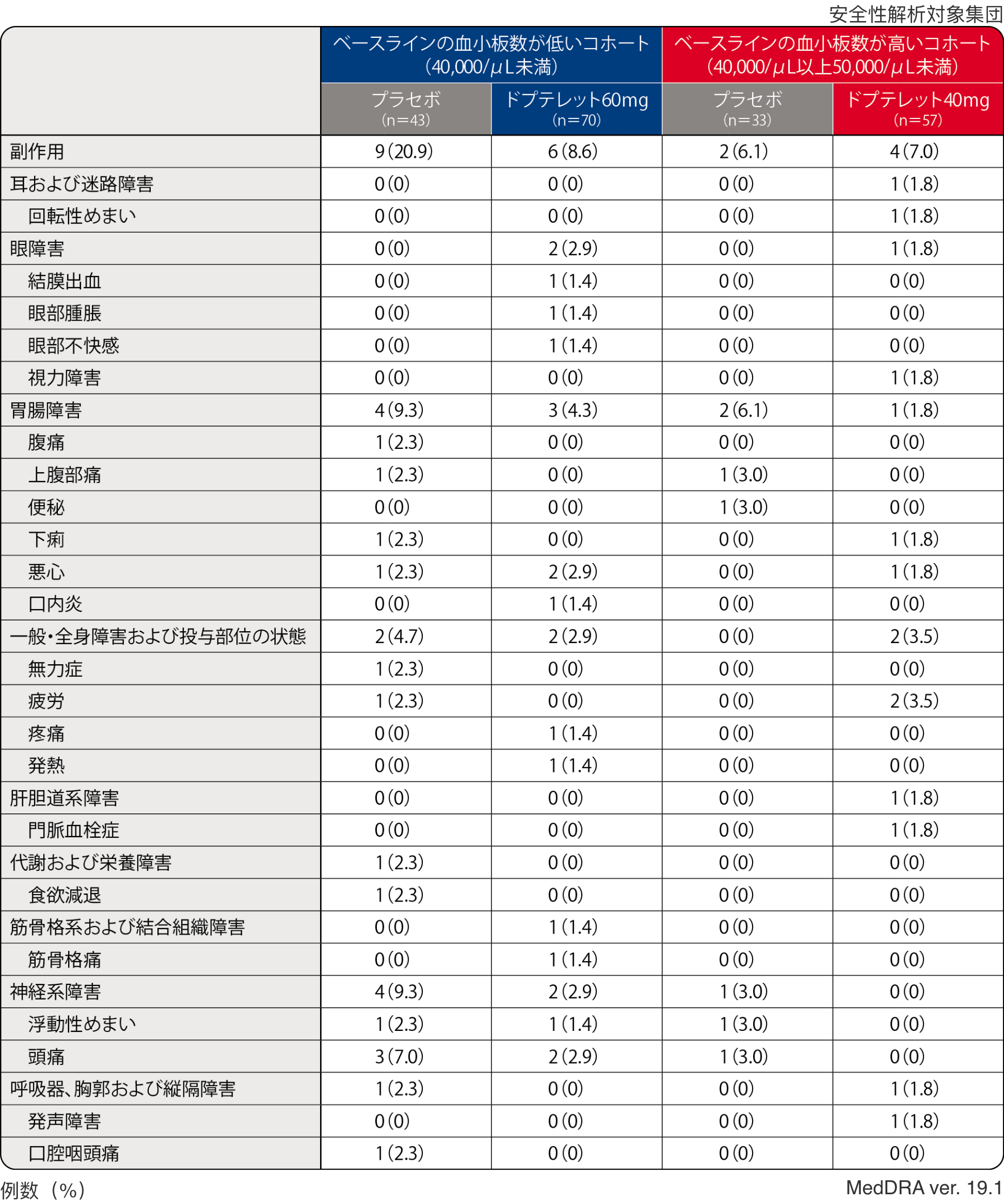
1. 副作用
ベースラインの⾎⼩板数が低いコホート(40,000/μL未満)における副作⽤はプラセボ群20.9%(9/43例)、ドプテレット60mg群8.6%(6/70例)、ベースラインの⾎⼩板数が⾼いコホート(40,000/μL以上50,000/μL未満)における副作⽤はプラセボ群6.1%(2/33例)、ドプテレット40mg群7.0%(4/57例)に認められ、その内訳は下表のとおりでした。
2. 重篤な副作用
本試験において、プラセボ群及びドプテレット群で重篤な副作⽤は認められませんでした。
3. 投与中止に至った副作用
本試験において、プラセボ群及びドプテレット群で投与中⽌に⾄った副作⽤は認められませんでした。
4. 死亡
死亡は、ベースラインの⾎⼩板数が⾼いコホート(40,000/μL以上50,000/μL未満)におけるプラセボ群で1例(急性⼼筋梗塞・多臓器機能不全症候群)に認められましたが、治験薬と関連なしと判断されました。
試験概要
| 目的 | 血小板減少症を伴う慢性肝疾患患者での、ランダム割り付けから待機的な観血的手技の7日後までの出血に対する血小板輸血及び止血処置の回避率について、ドプテレット(血小板数40,000/μL未満の被験者には60mg、40,000/μL以上50,000/μL未満の被験者には40mg)のプラセボに対する優越性を検証する。 |
|---|---|
| 試験デザイン | 国際共同、多施設共同、ランダム化、二重盲検、プラセボ対照、並行群間比較試験 |
| 対象 | 待機的な観血的手技を予定する血小板減少症を伴う成人の慢性肝疾患患者204例(日本人50例を含む) |
| 方法 |
ランダム化前期間には、被験者の血小板数が2回測定(2回の測定がいずれも60,000/μL以下、2回の測定の平均値が50,000/μL未満)され、ベースラインの平均血小板数に基づいて「ベースラインの血小板数が低いコホート(40,000/μL未満)」又は「ベースラインの血小板数が高いコホート(40,000/μL以上50,000/μL未満)」のいずれかに分けられた。各コホート内で被験者をさらに待機的な観血的手技の出血リスク(低、中、高)※1及び肝細胞癌の状態(あり、なし)により層別し、プラセボ群又はドプテレット群にランダムに1:2で割り付けた。


|
| 主な選択基準 |
|
| 主な除外基準 |
|
| 有効性評価項目 |
〔主要評価項目〕
〔副次評価項目〕
〔探索的評価項目〕
|
| 安全性評価項目 |
|
| 解析計画 |
有効性の解析
有効性の解析は、すべてのランダム割り付けされた被験者集団(FAS)を主要な解析対象集団として実施した。 安全性の解析 安全性の解析は、治験薬が1回以上投与され、投与後の安全性評価が1回以上実施された被験者集団(安全性解析対象集団)を対象に実施した。 |
社内資料:国際共同第Ⅲ相試験(E5501-G000-311試験)(2023年3月27日承認、申請資料概要2.7.6.19)(承認時評価資料)
Terrault N, et al.:Gastroenterology 155:705, 2018(PMID:29778606)[著者にDOVA社(現Swedish Orphan Biovitrum Japan)社員が含まれる。]






























