ドプテレット製品メニュー
- ドプテレット®トップ
- セミナー・講演会
- ドプテレット®について持続性及び慢性免疫性血小板減少症(ITP)
- ドプテレット®について慢性肝疾患に伴う血小板減少
- 資料ライブラリ
- 持続性及び慢性免疫性血小板減少症(ITP)
- 慢性肝疾患に伴う血小板減少
- ドプテレット製品詳細
- ドプテレット®トップ
- セミナー・講演会
- ドプテレット®について持続性及び慢性免疫性血小板減少症(ITP)
- ドプテレット®について慢性肝疾患に伴う血小板減少
- 資料ライブラリ
- 持続性及び慢性免疫性血小板減少症(ITP)
- 慢性肝疾患に伴う血小板減少
PhaseⅢにおける待機的な観血的手技
国際共同第Ⅲ相試験(日本人を含む)及び海外第Ⅲ相試験における待機的な観血的手技 (ドプテレット投与群)
2つの第Ⅲ相試験 において、ベースラインの血小板数が低いコホート( 40,000/ μL 未満)及びベースラインの血小板数が高いコホート( 40,000/ μL 以上、 50,000/ μL 未満)で、実際に施行された待機的な観血的手技は以下のとおりでした。
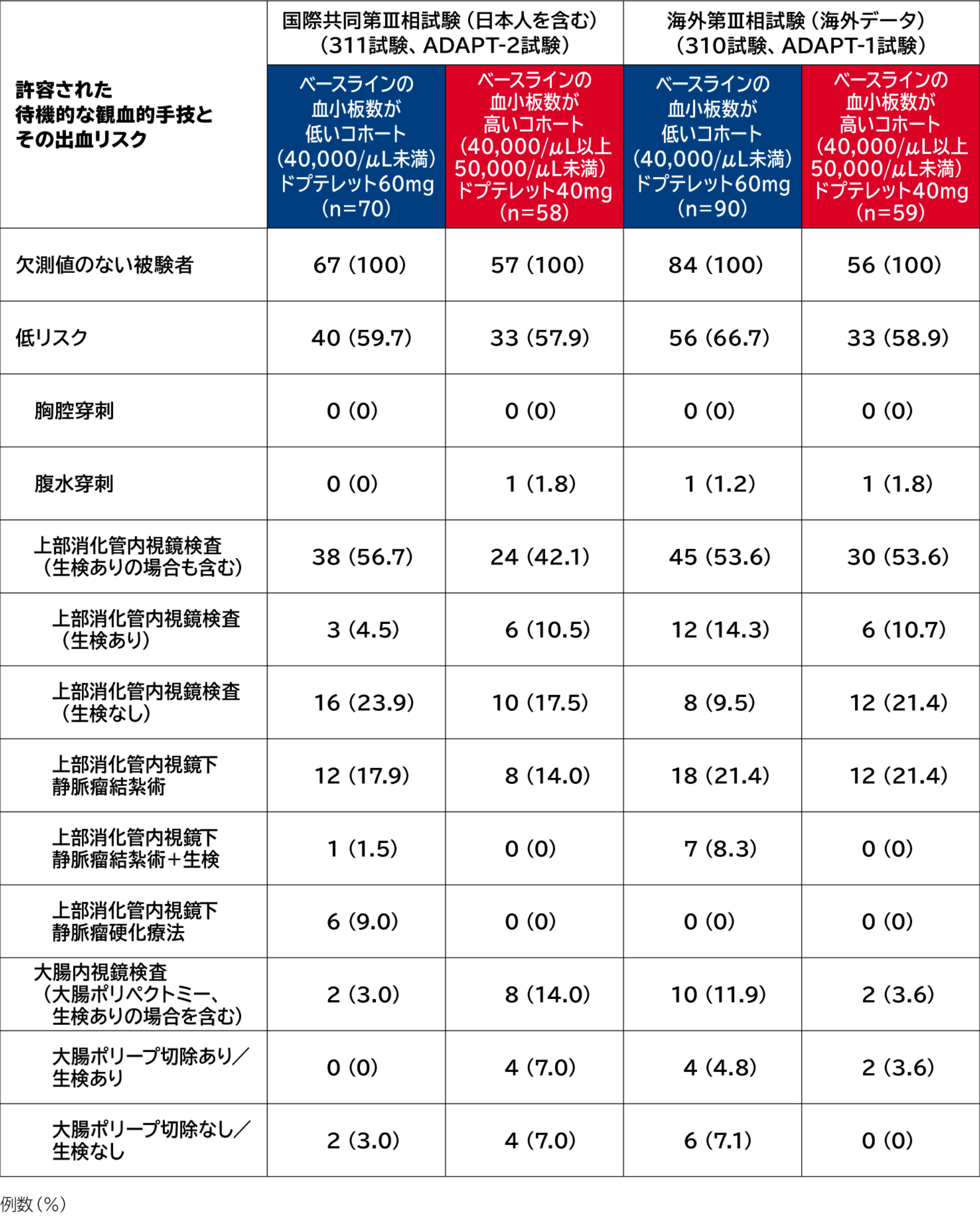
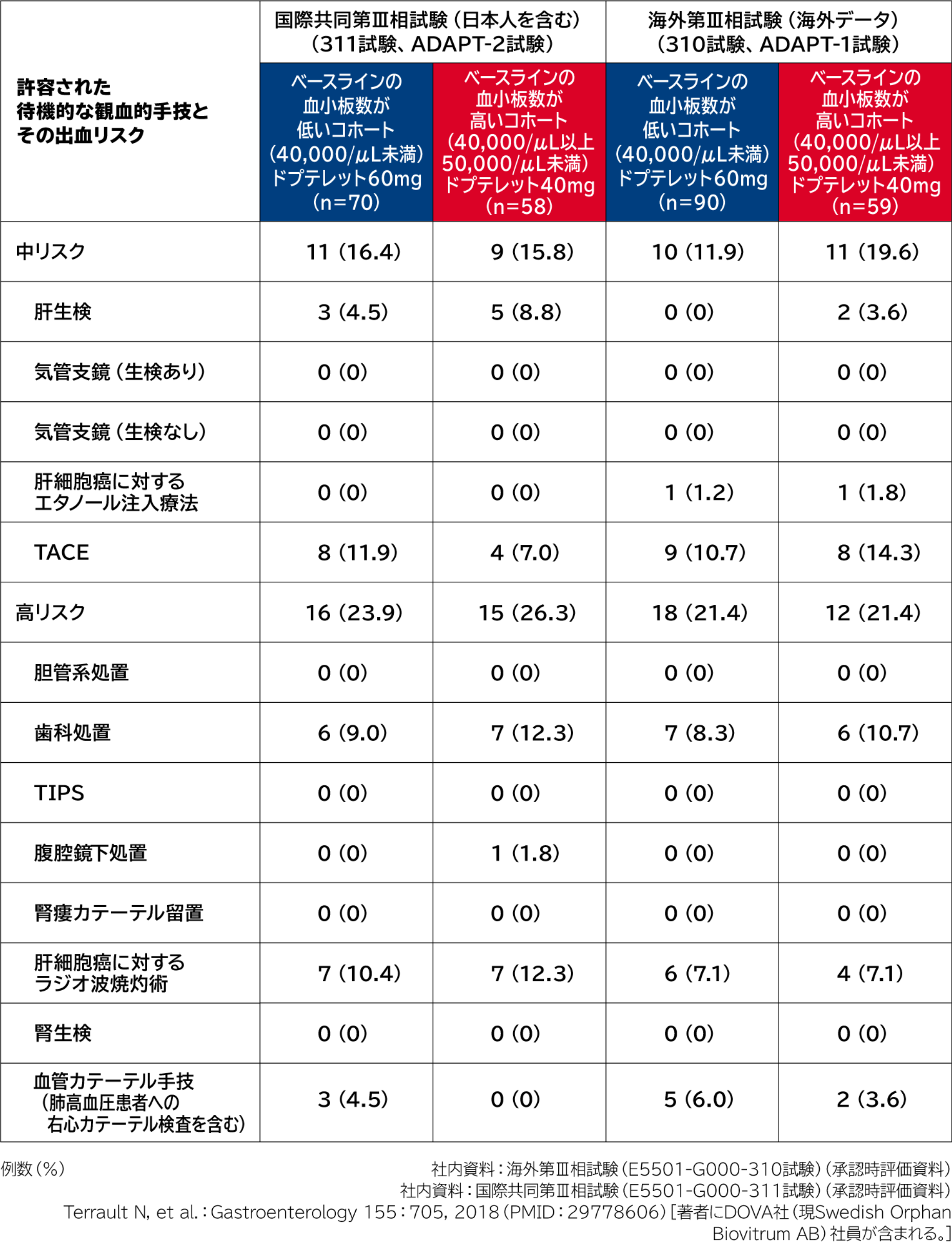
各試験の試験概要等は下記をご参照ください。
閲覧履歴
お問い合わせ(本社)