- ドプテレット®トップ
- セミナー・講演会
- ドプテレット®について持続性及び慢性免疫性血小板減少症(ITP)
- ドプテレット®について慢性肝疾患に伴う血小板減少
- 資料ライブラリ
- 持続性及び慢性免疫性血小板減少症(ITP)
- 慢性肝疾患に伴う血小板減少
- ドプテレット製品詳細
- ドプテレット®トップ
- セミナー・講演会
- ドプテレット®について持続性及び慢性免疫性血小板減少症(ITP)
- ドプテレット®について慢性肝疾患に伴う血小板減少
- 資料ライブラリ
- 持続性及び慢性免疫性血小板減少症(ITP)
- 慢性肝疾患に伴う血小板減少
海外第Ⅲ相試験(E5501-G000-302試験):検証的試験(海外データ)
外国人成人慢性ITP患者を対象とした血小板減少症の治療におけるドプテレットとプラセボの比較試験
有効性
血小板反応の累積週数〔主要評価項目〕検証的解析結果
血小板反応の累積週数(26週間の投与期間中、救援療法を実施せずに、血小板数が50,000/μL以上となった累積週数)の中央値は、プラセボ群0週、ドプテレット群12.4週、群間差は12.4週であり、ドプテレット群ではプラセボ群に比べて血小板反応の累積週数が有意に長かったため、ドプテレット群のプラセボ群に対する優越性が検証されました。26週間の投与期間における、ドプテレット群の血小板数の中央値の推移は以下のとおりでした。
血小板反応の累積週数
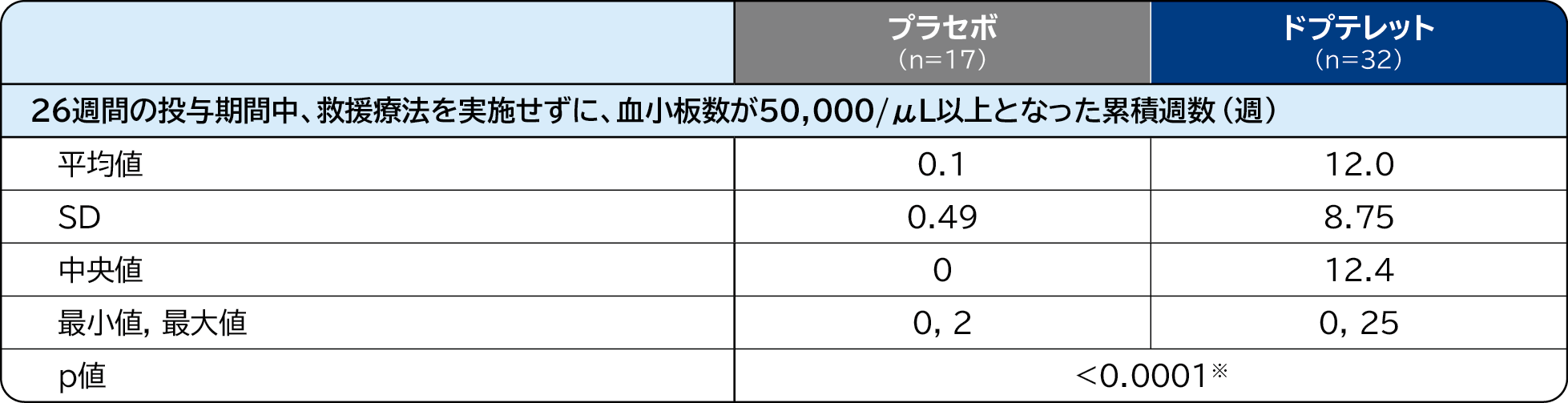
- 解析対象集団:FAS Wilcoxon Rank Sum検定 ※:有意水準α=0.05
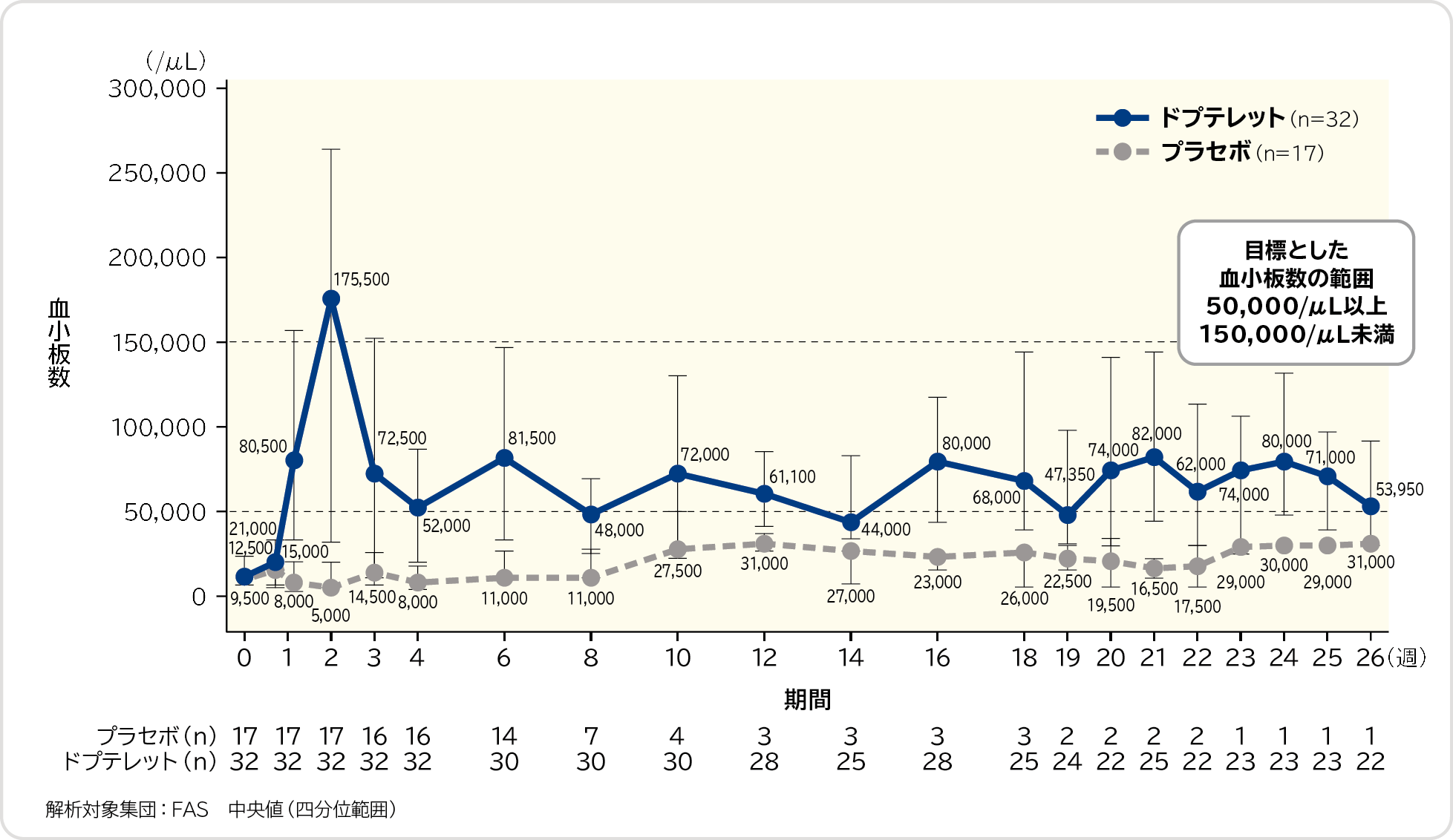
血小板数の中央値の推移
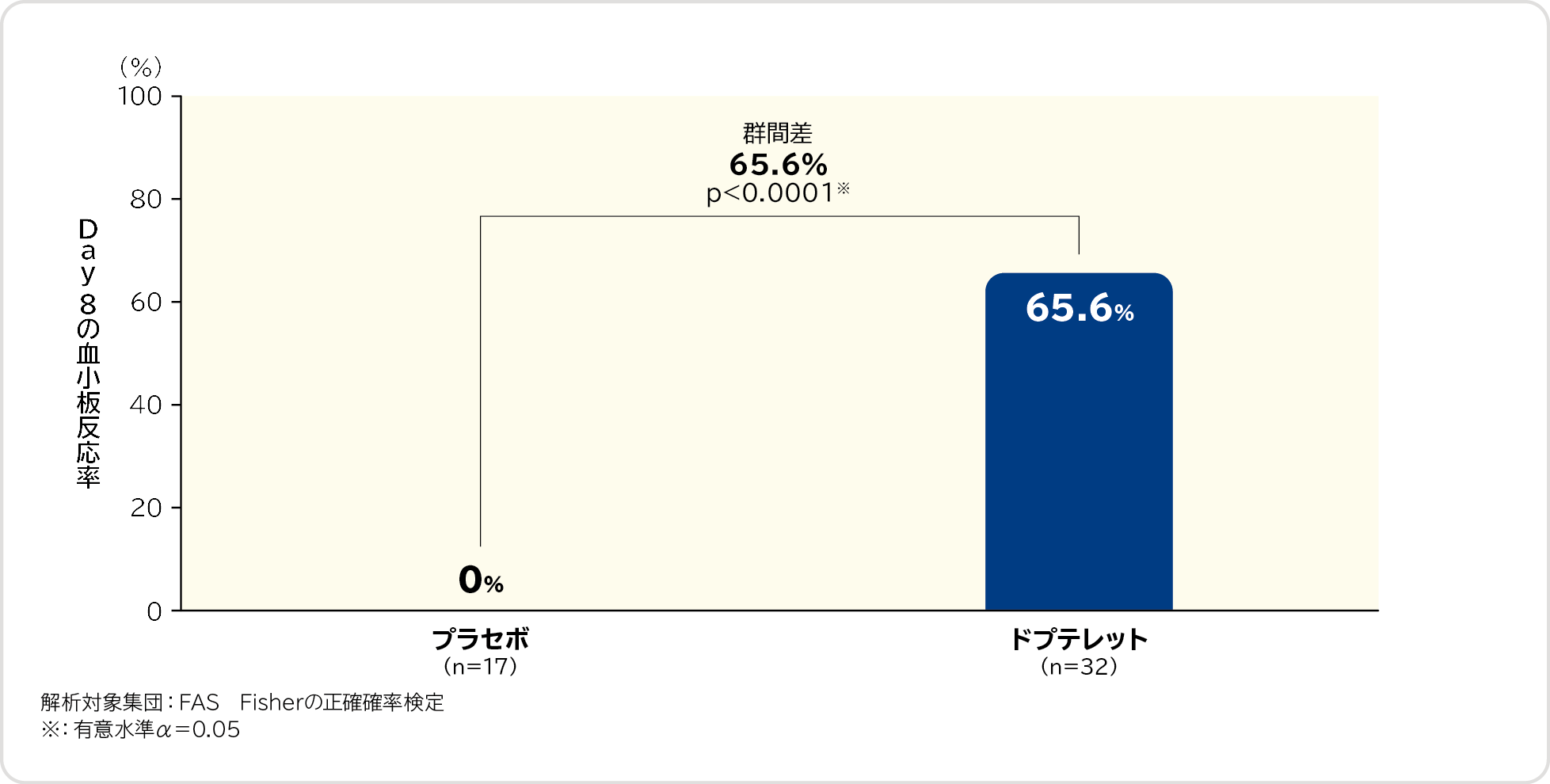
Day 8の血小板反応率〔重要な副次評価項目〕検証的解析結果
Day 8の血小板反応率(救援療法を実施せずに、Day 8の血小板数が50,000/μL以上であった被験者の割合)は、プラセボ群0%(0/17例)、ドプテレット群65.6%(21/32例)、群間差は65.6%であり、ドプテレット群ではプラセボ群に比べて血小板反応率が有意に高かったため、ドプテレット群のプラセボ群に対する優越性が検証されました。
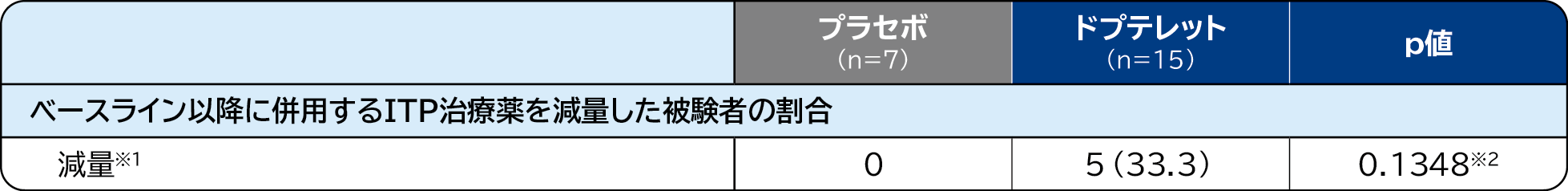
ベースライン以降に併用するITP治療薬を減量した被験者の割合 〔重要な副次評価項目〕
ベースライン時に併用するITP治療薬を使用していたプラセボ群の7例[副腎皮質ステロイド薬7例、止血剤3例、タンパク同化ステロイド薬1例、免疫抑制剤(シクロスポリンA注))1例、免疫抑制剤(その他)1例、重複あり]のうち、ベースライン以降に併用するITP治療薬を減量した被験者は0例であったのに対して、ドプテレット群では15例(副腎皮質ステロイド薬14例、止血剤3例、重複あり)のうち5例[33.3%(副腎皮質ステロイド薬5例)]であり、統計学的な有意差は認められませんでした。
- 注)国内適応外
-
例数(%)
解析対象集団:FAS Fisherの正確確率検定
-
※1:
ベースライン時にITP治療薬を併用していた被験者で、26週間の投与期間中、救援療法を実施せずに、維持期間全体を通して1種類以上のITP治療薬の用量がベースラインから
減量した被験者用可能な用量レベルは5mg、10mg、20mg(開始時)、30mg、40mgであった。 - ※2: 名目上のp値、有意水準α=0.05
社内資料:海外第Ⅲ相試験(E5501-G000-302試験)(2025年8月承認、申請資料概要2.7.6.4)(参考資料:承認審査過程で評価された試験成績)
Jurczak W, et al.:Br J Haematol 183:479, 2018(PMID:30191972)
安全性
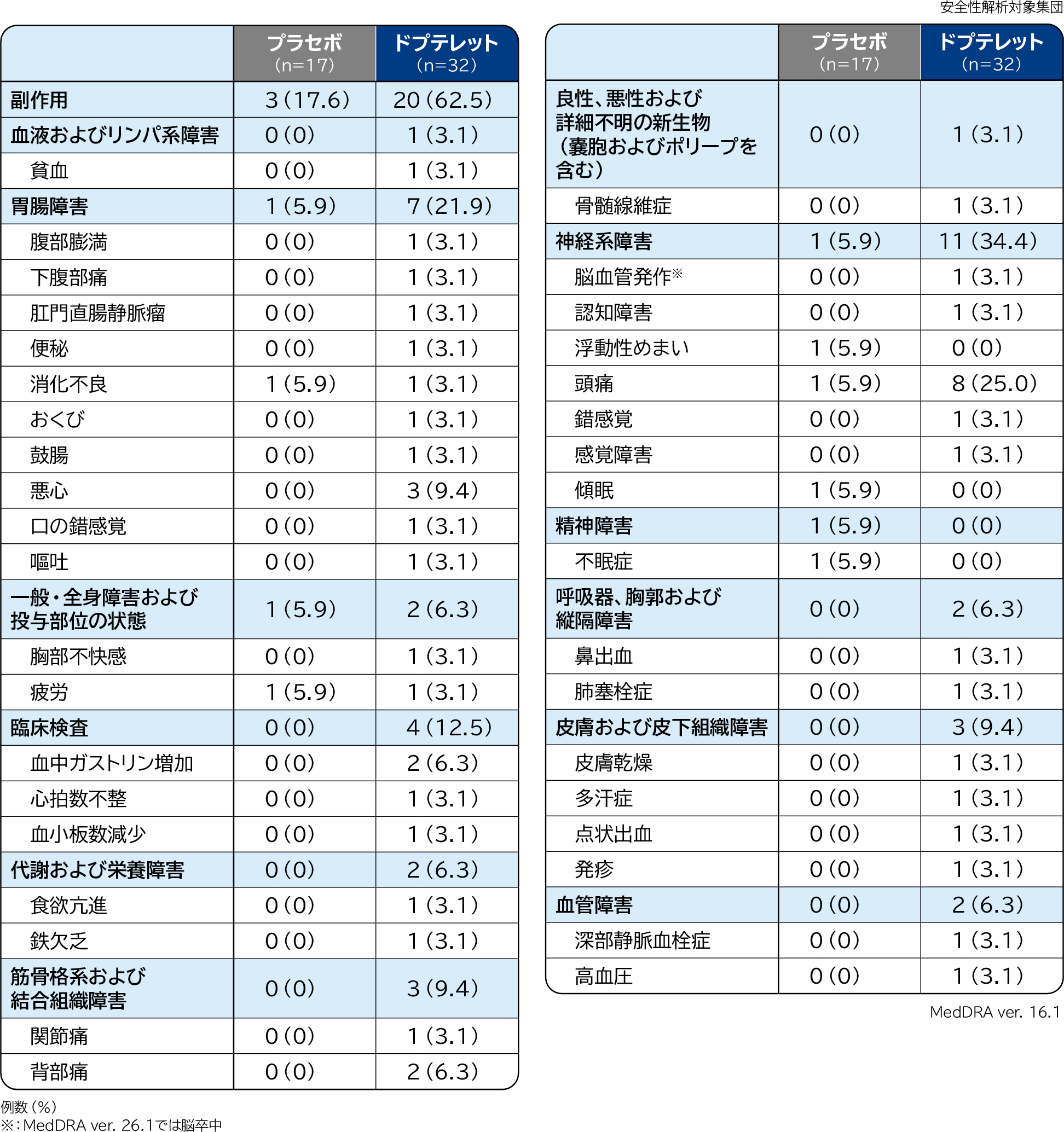
1.副作用
コア期における副作用はプラセボ群17.6%(3/17例)、ドプテレット群62.5%(20/32例)に認められ、その内訳は下表のとおりでした。
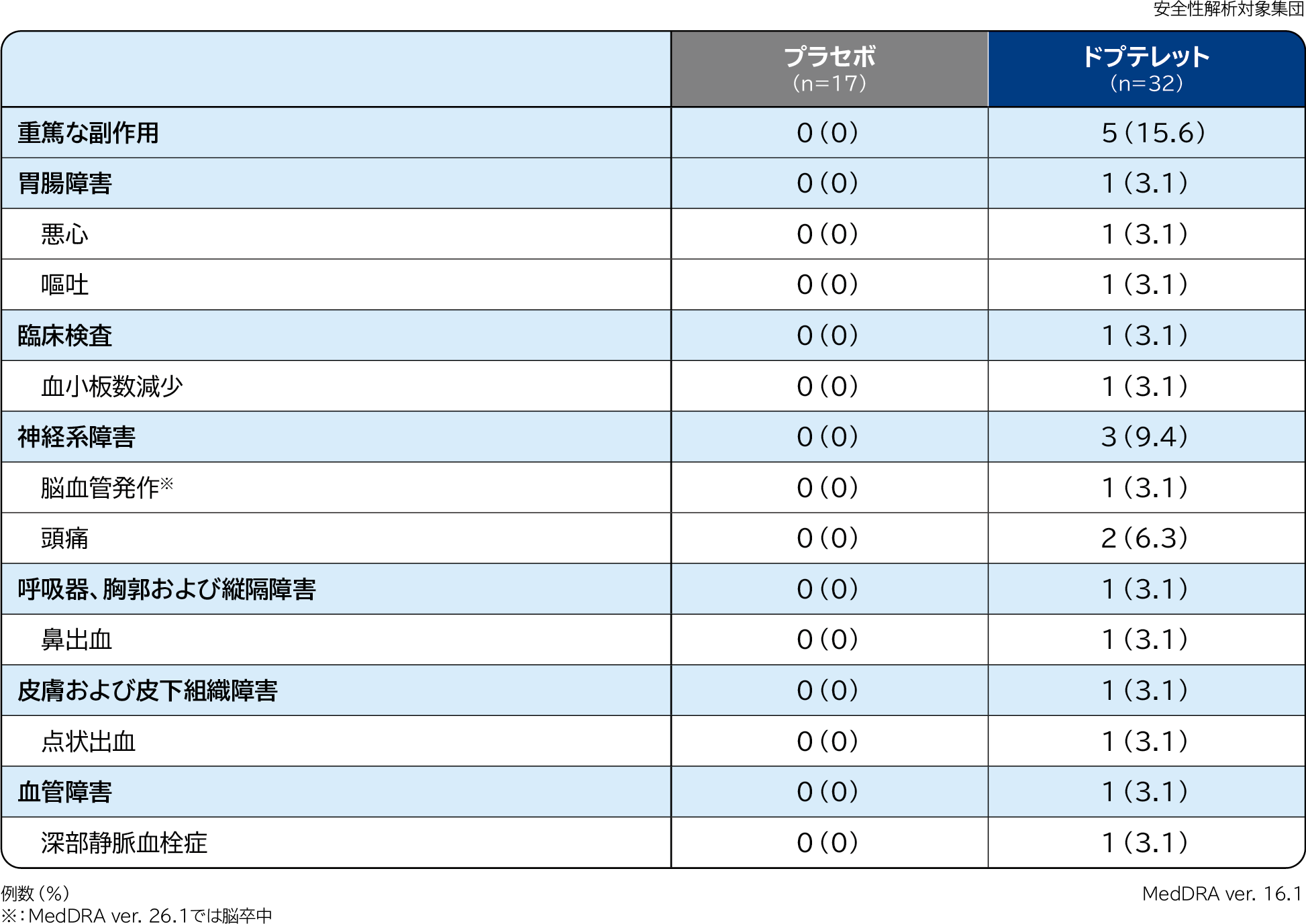
2.重篤な副作用
コア期における重篤な副作用はプラセボ群0%(0/17例)、ドプテレット群15.6%(5/32例)に認められ、その内訳は下表のとおりでした。
3.投与中止に至った副作用
コア期における投与中止に至った副作用は、ドプテレット群で2例(脳血管発作1例、頭痛1例)に認められました。
4.死亡
本試験のコア期において、死亡は認められませんでした。
血栓塞栓症(副作用)
本試験のコア期において、血栓塞栓症はドプテレット群で3例[脳血管発作※1例(重篤)、深部静脈血栓症1例(重篤)、肺塞栓症1例]に認められました。また、継続期において、頚静脈血栓症(重篤)が1例に認められ、本試験全体では4例(n=47、8.5%)でした(コア期+継続期通じての平均曝露期間43.9週)。
- ※:MedDRA ver. 26.1では脳卒中
社内資料:海外第Ⅲ相試験(E5501-G000-302試験)(2025年8月承認、申請資料概要2.7.6.4)(参考資料:承認審査過程で評価された試験成績)
Jurczak W, et al.:Br J Haematol 183:479, 2018(PMID:30191972)
試験概要
| 目的 | 1種類以上の前治療を受けた成人ITP患者において、血小板反応の累積週数を指標として、標準治療に上乗せしたドプテレットのプラセボに対する優越性を評価する。主要評価期(コア期)とともに、ドプテレットの長期投与の安全性及び忍容性を評価する(継続期)。 |
|---|---|
| 対象 | 1種類以上の前治療を受け、2回測定した血小板数の平均値が30,000/μL未満であった外国人成人慢性ITP患者49例 |
| 試験デザイン | 国際共同、多施設共同、ランダム化、二重盲検、プラセボ対照、並行群間比較試験 |
| 方法 |
(コア期)
(継続期) 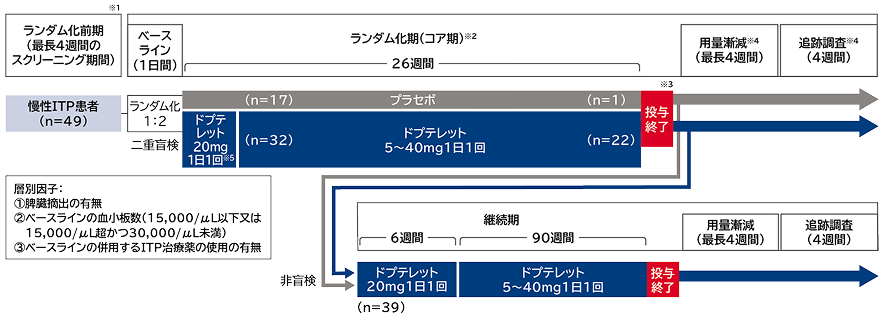
|
- *免疫性血小板減少症の発症又は診断後6カ月以上経過した患者に投与すること。
ドプテレットの用量調節方法

-
※6:使用可能な用量レベルは5mg、10mg、20mg(開始時)、30mg、40mgであった。
注)本試験では投与群のみを盲検化し、用量レベルは盲検化しなかった。
| 有効性評価項目 |
(コア期) 〔主要評価項目〕
〔重要な副次評価項目〕
<救援療法について>
|
|---|---|
| 安全性評価項目 |
|
| 解析計画 |
有効性の解析(コア期)
有効性の解析は、FASを主要な解析対象集団として実施した。 安全性の解析 安全性の解析は、治験薬が1回以上投与され、投与後の安全性評価が1回以上実施された被験者集団(安全性解析対象集団)を対象に実施した。 |
| 主な選択基準 |
(コア期)
|
| 主な除外基準 |
(コア期)
|
- *免疫性血小板減少症の発症又は診断後6カ月以上経過した患者に投与すること。
ただし、血小板数が50,000/μL未満又は400,000/μL超の場合、1週間に1回、用量調節を行ってもよい。
| 用法・用量 | レベル |
|---|---|
| 40mgを1日1回投与 | 6 |
| 40mgを週3回及び20mgを各週の残り4日に投与 | 5 |
| 20mgを1日1回投与 | 4 |
| 20mgを週3回投与 | 3 |
| 20mgを週2回投与又は40mgを週1回投与 | 2 |
| 20mgを週1回投与 | 1 |
- * 1日1回より少ない頻度で本剤を投与する場合は、連日投与を避け、週ごとに一貫した方法で服薬すること。
| 血小板数 | 調節方法 |
|---|---|
| 50,000/μL未満 |
用量レベルを1段階上げる。 ただし、最高投与量として1日1回40mgを4週間投与しても、臨床上重大な出血リスクを回避できるレベルに血小板数が増加しなかった場合は、本剤の投与を中止するなど、適切な処置を行うこと。 |
| 50,000/μL以上 200,000/μL未満 |
現状の用量レベルを維持する。 ただし、出血のリスクを低下できる治療上必要最小限の用法・用量となるよう、適宜減量も考慮すること。 |
| 200,000/μL以上 400,000/μL以下 |
用量レベルを1段階下げる。 |
| 400,000/μL超 |
本剤を休薬し、血小板数を週2回測定する。休薬後、血小板数が150,000/μL未満まで減少した場合は、休薬前からの用量レベルを1段階下げて投与を再開する。 ただし、最低投与量として週1回20mgを2週間投与しても血小板数が400,000/μL超の場合は、本剤の投与を中止すること。 |
社内資料:海外第Ⅲ相試験(E5501-G000-302試験)(2025年8月承認、申請資料概要2.7.6.4)(参考資料:承認審査過程で評価された試験成績)
Jurczak W, et al.:Br J Haematol 183:479, 2018(PMID:30191972)[著者にDOVA社(現Swedish Orphan Biovitrum)社員が含まれる。]






























