- ドプテレット®トップ
- セミナー・講演会
- ドプテレット®について持続性及び慢性免疫性血小板減少症(ITP)
- ドプテレット®について慢性肝疾患に伴う血小板減少
- 資料ライブラリ
- 持続性及び慢性免疫性血小板減少症(ITP)
- 慢性肝疾患に伴う血小板減少
- ドプテレット製品詳細
- ドプテレット®トップ
- セミナー・講演会
- ドプテレット®について持続性及び慢性免疫性血小板減少症(ITP)
- ドプテレット®について慢性肝疾患に伴う血小板減少
- 資料ライブラリ
- 持続性及び慢性免疫性血小板減少症(ITP)
- 慢性肝疾患に伴う血小板減少
国内第Ⅲ相試験(AVA-ITP-307試験):検証的試験
日本人成人慢性ITP患者を対象とした血小板減少症の治療におけるドプテレットの有効性及び安全性を評価する非盲検試験
有効性
血小板反応の累積週数〔主要評価項目〕検証的解析結果
血小板反応の累積週数(26週間の投与期間中、救援療法を実施せずに、血小板数が50,000/μL以上となった累積週数)の平均値は13.47週(95%CI:9.13, 17.80)でした。95%CIの下限値9.13週は、事前に規定した本試験の有効性閾値8.02週以上であり、ドプテレットの有効性が検証されました。

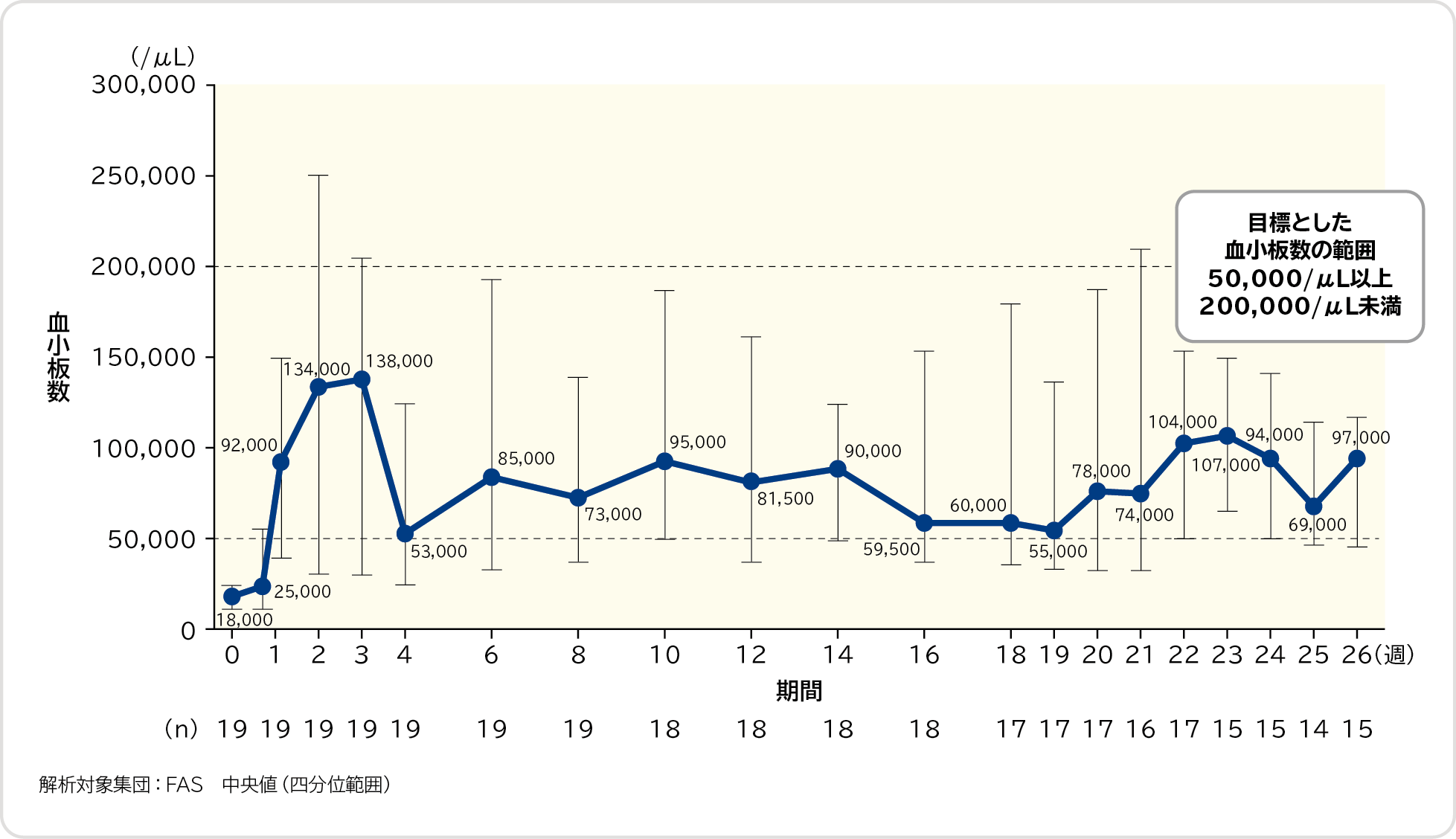
血小板数の中央値の推移〔その他の評価項目〕
26週間の投与期間における血小板数の中央値の推移は以下のとおりでした。
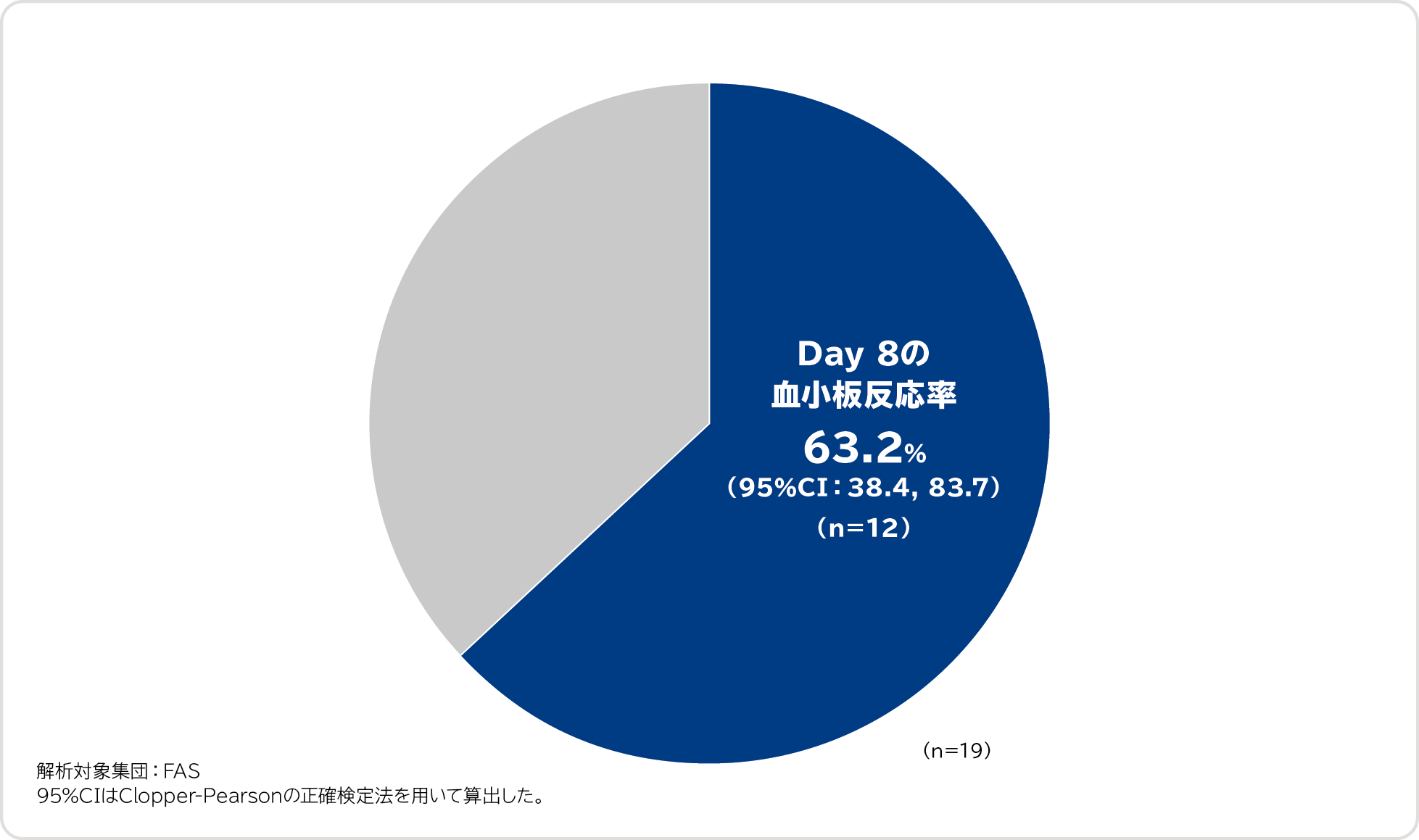
Day 8の血小板反応率〔重要な副次評価項目〕
Day 8の血小板反応率(救援療法を実施せずに、Day 8の血小板数が50,000/μL以上であった被験者の割合)は63.2%(12/19例)でした。
ベースライン以降に併用するITP治療薬を減量/使用中止した被験者の割合〔その他の評価項目〕
ベースライン時に併用するITP治療薬を使用していた9例(副腎皮質ステロイド薬8例、シクロスポリンA注)1例)のうち、ベースライン以降に併用するITP治療薬を減量した被験者は5例(副腎皮質ステロイド薬4例、シクロスポリンA注)1例)、使用中止した被験者は1例(副腎皮質ステロイド薬1例)でした。
- 注)国内適応外

-
例数
解析対象集団:FAS - ※1: ベースライン時にITP治療薬を併用していた被験者で、26週間の投与期間中に同一の治療薬のベースライン以降すべての1日当たりの総使用量がベースライン時以上に増えることなく減量した、又はベースライン以降にITP治療薬を使用しなかった被験者
- ※2: ベースライン時にITP治療薬を併用していた被験者で、26週間の投与期間の最終投与前にすべてのITP治療薬の使用を中止した被験者
社内資料:国内第Ⅲ相試験(AVA-ITP-307試験)(2025年8月承認、申請資料概要2.7.6.1)(承認時評価資料)
Yamaguchi H, et al.:Int J Hematol 2025 May 20. doi:10.1007/s12185-025-04001-4. Online ahead of print.
(PMID:40392465)
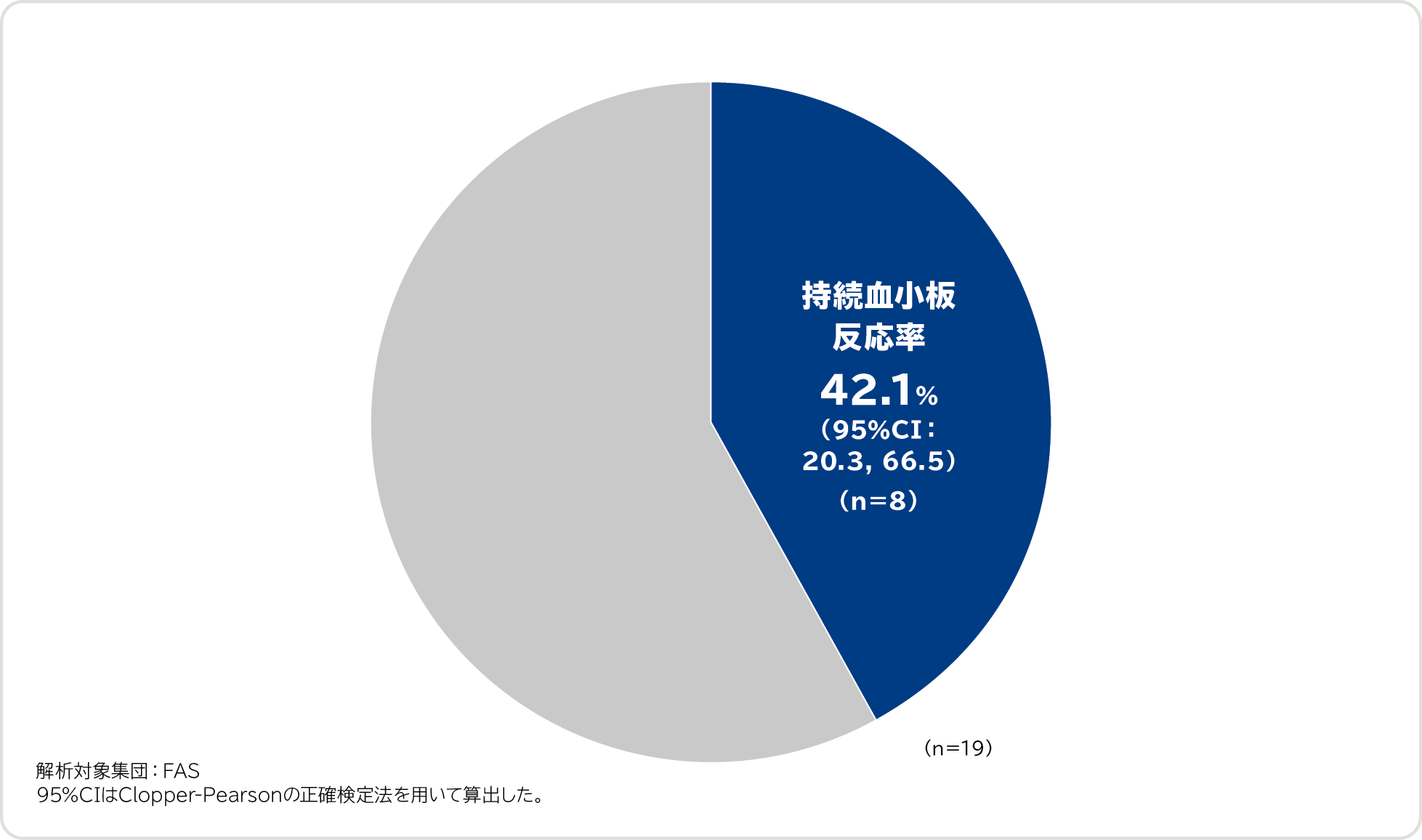
持続血小板反応率〔その他の評価項目〕
持続血小板反応率[26週間の投与期間中、救援療法を実施せずに、最後の8週間のうち6週間以上(75%以上)で血小板数が50,000/μL以上となった被験者の割合]は42.1%(8/19例)でした。
安全性
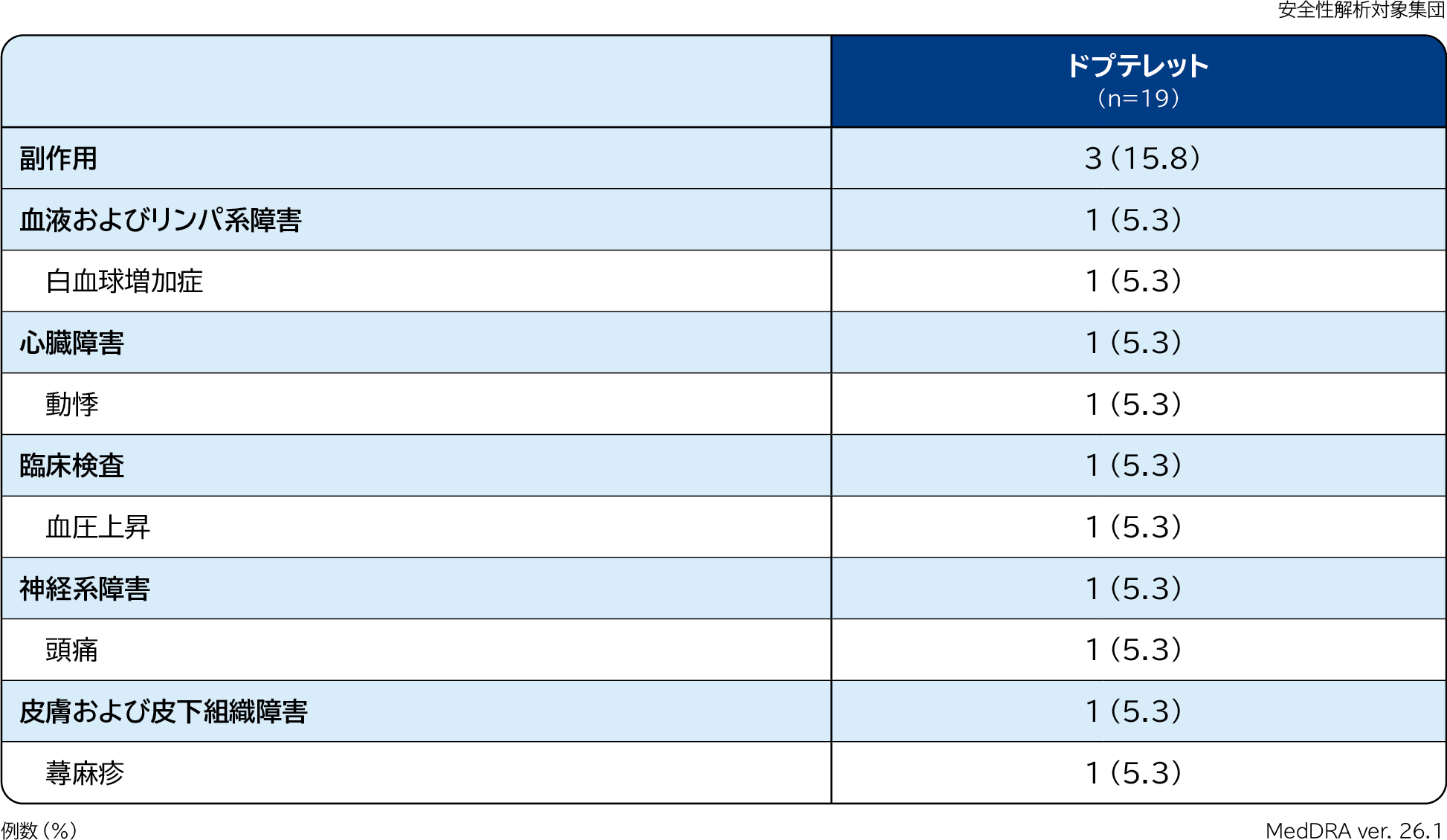
1.副作用
コア期における副作用は15.8%(3/19例)に認められ、その内訳は下表のとおりでした。
2.重篤な副作用
本試験のコア期において、重篤な副作用は認められませんでした。
3.投与中止に至った副作用
本試験のコア期において、投与中止に至った副作用は認められませんでした。
4.死亡
本試験のコア期において、死亡は認められませんでした。
血栓塞栓症(副作用)
本試験のコア期において、血栓塞栓症は認められませんでしたが、継続期において、
脳卒中が1例(5.3%)に認められました(コア期+継続期通じての平均曝露期間61.9週)。
社内資料:国内第Ⅲ相試験(AVA-ITP-307試験)(2025年8月承認、申請資料概要2.7.6.1)(承認時評価資料)
Yamaguchi H, et al.:Int J Hematol 2025 May 20. doi:10.1007/s12185-025-04001-4. Online ahead of print.
(PMID:40392465)
試験概要
| 目的 | 26週間の投与期間中、救援療法を実施せずに、血小板数が50,000/μL以上となった累積週数に基づき、日本人成人慢性ITP患者におけるドプテレットの有効性を評価する。主要評価期(コア期)とともに、ドプテレットの長期投与の安全性及び忍容性を評価する(継続期)。 |
|---|---|
| 対象 | 過去のITP治療が効果不十分であり、2回測定した血小板数の平均値が30,000/μL未満であった日本人成人慢性ITP患者19例 |
| 試験デザイン | 多施設共同、非盲検、非対照試験 |
| 方法 |
(コア期)
(継続期) 
|
| 有効性評価項目 |
(コア期) 〔主要評価項目〕
〔重要な副次評価項目〕
〔その他の評価項目〕
<救援療法について>
|
| 安全性評価項目 |
|
| 解析計画 |
有効性の解析(コア期)
有効性の解析は、本試験に組み入れられたすべての被験者集団(FAS)を主要な解析対象集団として実施した。
安全性の解析 安全性の解析は、治験薬が1回以上投与され、投与後の安全性評価が1回以上実施された被験者集団(安全性解析対象集団)を対象に実施した。 |
| 主な選択基準 |
(コア期)
|
| 主な除外基準 |
(コア期)
|
社内資料:国内第Ⅲ相試験(AVA-ITP-307試験)(2025年8月承認、申請資料概要2.7.6.1)(承認時評価資料)
Yamaguchi H, et al.:Int J Hematol 2025 May 20. doi:10.1007/s12185-025-04001-4. Online ahead of print.
(PMID:40392465)
[著者にSwedish Orphan Biovitrum 社員が含まれる。]






























