海外第Ⅲ相臨床試験 HORIZON-PFTの新規椎体骨折発生率
海外第Ⅲ相臨床試験 HORIZON-PFTの主要評価項目である新規椎体骨折発生率とビスホネート製剤治療経験のある患者での新規椎体骨折発生率
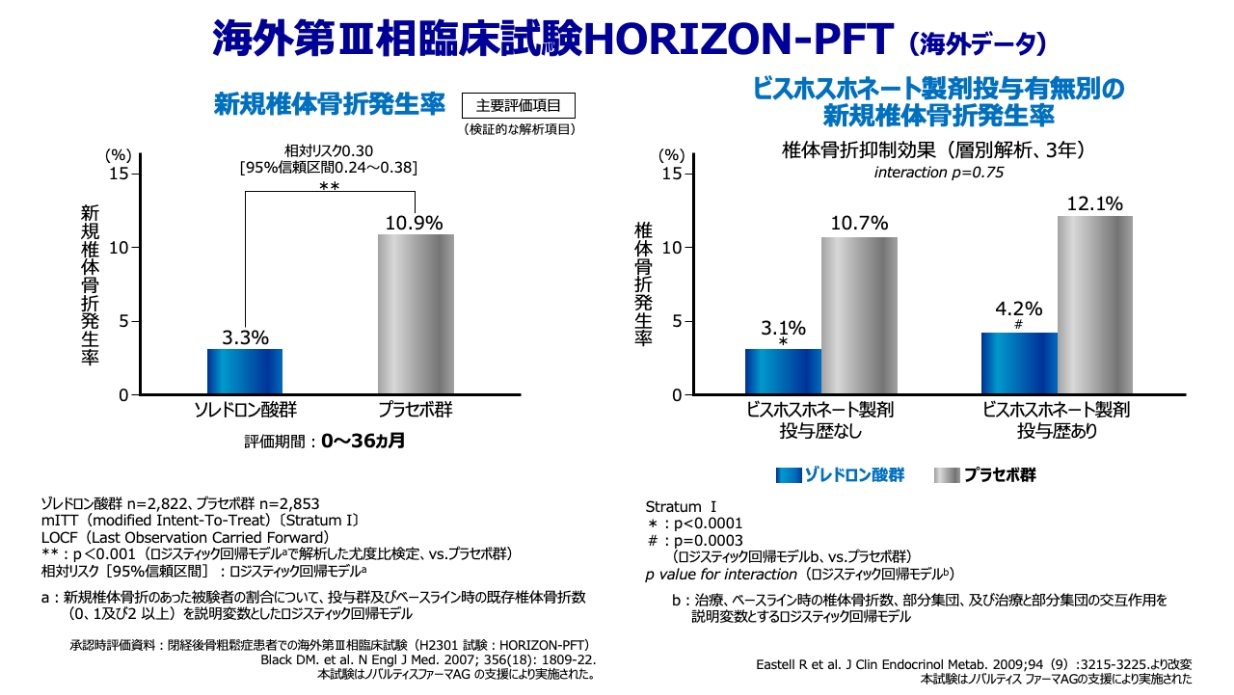
主要評価項目の結果
投与後36ヵ月間の新規椎体骨折発生率はゾレドロン酸群で3.3%、プラセボ群で10.9%であり、ゾレドロン酸はプラセボに対して新規椎体骨折の発生を有意に抑制しました(p<0.001、尤度比検定)。Kaplan-Meier推定法に基づく36ヵ月間の大腿骨近位部骨折の累積発生率はゾレドロン酸群で1.4%、プラセボ群で2.5%でした(ハザード比0.59、95%信頼区間0.42~0.83、Cox回帰モデルa)。
a:投与群を因子とし、無作為化以前の骨粗鬆症治療薬の使用歴に基づいて層化したCox比例ハザード回帰モデル
副作用
主な副作用はゾレドロン酸群で発熱617例(16.0%)、筋肉痛362 例(9.4%)、インフルエンザ様疾患301 例(7.8%)、関節痛261 例(6.8%)、頭痛250例(6.5%)等、プラセボ群で発熱78例(2.0%)、頭痛73例(1.9%)、筋肉痛62例(1.6%)、インフルエンザ様疾患59 例(1.5%)、関節痛52例(1.4%)等であった。なお、重篤な副作用はゾレドロン酸群31例(膀胱癌2例、徐脈性不整脈、失神、薬物過敏症、大葉性肺炎、幻覚/筋炎/横紋筋融解症、発熱/頭痛/筋肉痛、背部痛/浮動性めまい、開口障害、筋骨格痛/悪寒/発熱/無力症、虚血性脳卒中、高熱、腎嚢胞、肝酵素上昇、緑内障、関節痛/発熱、急性膵炎、口の錯感覚/洞性頻脈、大腿骨骨折、筋肉痛、疼痛、関節痛/高熱、甲状腺髄様癌、乳頭様甲状腺癌、背部痛/浮動性めまい/発熱/頭痛/筋肉痛/悪心/頸部痛/嘔吐/気道感染、発熱、慢性閉塞性肺疾患/インフルエンザ、有害事象、疼痛/無力症、腎クレアチニンクリアランス減少、各1例)であり、因果関係の否定できない死亡例はゾレドロン酸群の1例(膀胱癌)であった。また、副作用による投与中止例はゾレドロン酸群では30例(腎クレアチニンクリアランス減少6例、ぶどう膜炎3例、四肢痛2例、インフルエンザ様疾患2例、関節痛2例、薬物過敏症、潮紅/低血圧、下痢/嘔吐/関節腫脹/神経痛、関節痛/疲労/発熱/頭痛/眼刺激/筋肉痛/悪心/意識レベルの低下/傾眠/回転性めまい、悪寒/悪心/疲労、開口障害、筋骨格痛/悪寒/発熱/無力症、肝酵素上昇、筋肉痛、紅斑、洞性頻脈、事象不明、骨痛/悪寒/疲労/多汗症/頭痛、悪寒/頭痛/悪心、疼痛/無力症、各1例)であった。
試験概要
対象:
閉経後骨粗鬆症患者※1 7,736例
Intent-to-treat 集団(ITT)※2:ゾレドロン酸群3,875 例、プラセボ群3,861 例
Modified ITT集団(mITT)※2:ゾレドロン酸群2,822 例、プラセボ群2,853 例
安全性解析対象集団:ゾレドロン酸群3,862例、プラセボ群3,852例
投与方法:
ゾレドロン酸5mgまたはプラセボを1回15分以上かけて1年間隔で3回点滴静脈内投与し、3回目投与1年後までの3年間観察した。
なお、全患者に毎日、カルシウム1,000~1,500mg/日及びビタミンD 400~1,200IU/日を投与した。
無作為化以前の骨粗鬆症治療薬(通常治療※3)の使用歴に基づき、2つのStratumに層化
・Stratum I :ベースに骨粗鬆症治療を受けていない患者グループ
・Stratum II:ベースに骨粗鬆症治療薬1剤を使用しており、試験期間中、骨粗鬆症治療薬1剤を併用投与している患者グループ
評価項目:
[主要評価項目]36ヵ月間での新規椎体骨折発生率〔mITT(Stratum I)〕 、大腿骨近位部骨折の初発までの期間〔ITT(Stratum I+II)〕(検証的な解析項目)
[副次評価項目]12、24ヵ月間での新規椎体骨折発生率〔mITT(Stratum I)〕、骨密度〔腰椎、大腿骨近位部total(ベースラインからの変化率)〕等
解析計画:
36ヵ月間での新規椎体骨折発生率はロジスティック回帰モデルで解析した尤度比検定、大腿骨近位部骨折の初発までの期間はKaplan-Meier推定法に基づくlog-rank検定で解析した。また、年齢やビスホスホネート製剤投与経験の有無などによる層別解析を計画した。
※1:2個以上の軽度または1個以上の中等度の椎体骨折を有し、大腿骨頸部骨密度のTスコアが-1.5以下、あるいは、既存椎体骨折の有無にかかわらず大腿骨頸部骨密度のTスコアが-2.5以下の患者
※2: I T T 集団:無作為化された患者のうち、モニタリング及びデータレビューによりデータの信頼性に問題があることが確認された医療機関の患者29 例を除く全患者mITT 集団:ITT 集団のうち、各年の来院時に1個以上の評価可能な椎体を有するStratum Iの患者
※3:「通常治療」は、ホルモン補充療法(HRT)、選択的エストロゲン受容体モジュレーター(SERMs、ラロキシフェン等)、カルシトニン、チボロン、タモキシフェン、デヒドロエピアンドロステロン、イプリフラボン及びメドロキシプロゲステロン等による薬物治療を含み、ゾレドロン酸以外のビスホスホネート製剤は除外する
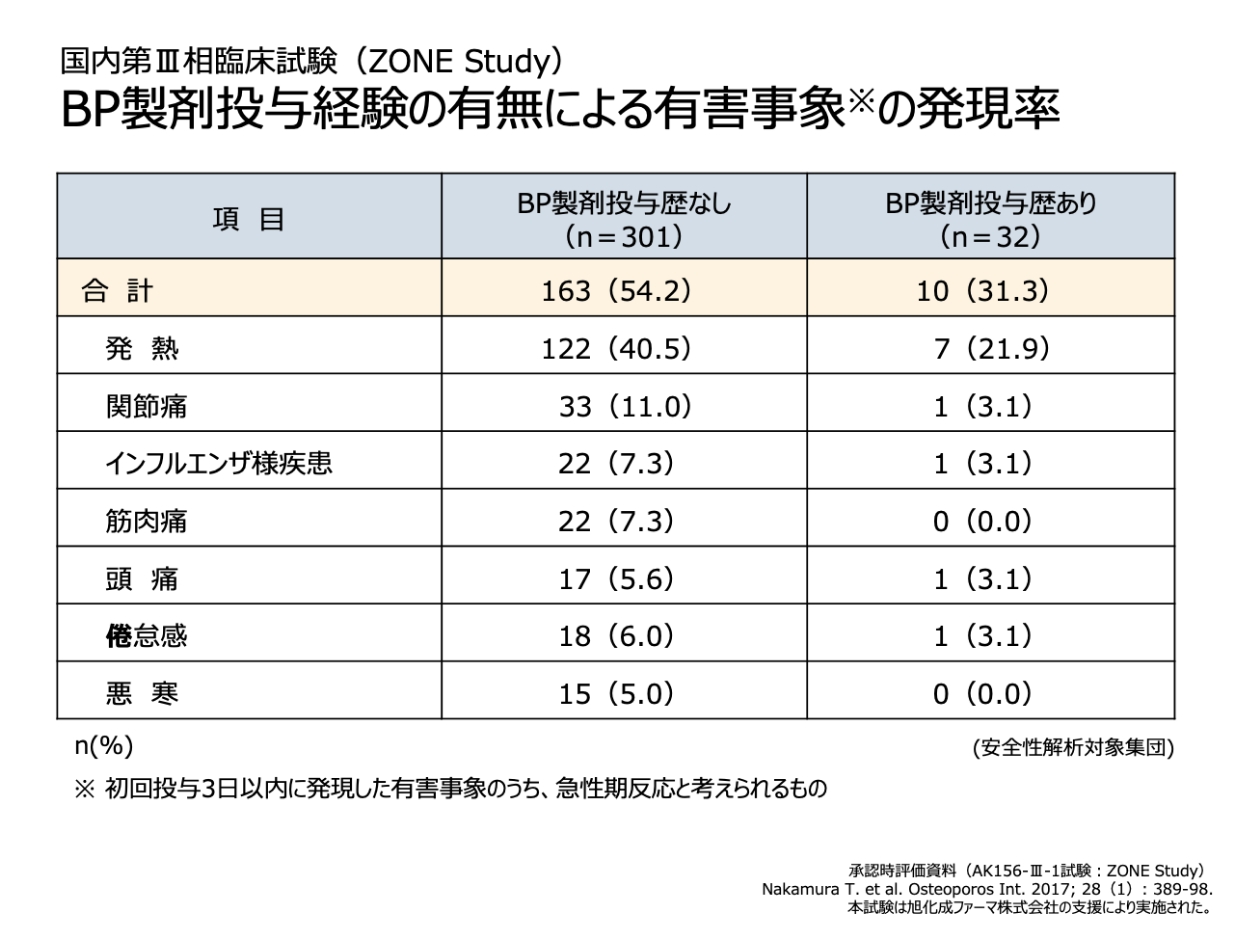
国内第Ⅲ相臨床試験 ZONE studyでの主な急性期反応の発現率
リクラスト投与に際し、ビスホスホネート製剤による治療経験のない患者では40.5%、治療経験のある患者では21.9%に発熱の発現がみられました。
試験概要
対象:
日本人原発性骨粗鬆症外来患者665例(女性625例、男性40例)
最大の解析対象集団:リクラスト群330例、プラセボ群331例
安全性解析対象集団:リクラスト群333例、プラセボ群332例
方法:
リクラスト5mgまたはプラセボを1回15分以上かけて1年間隔で2回点滴静脈内投与し、2回目投与1年後までの2年間観察した。なお、全患者に同意取得時から毎日、カルシウム610mg/日、ビタミンD3 400IU/日及びマグネシウム30mg/日を投与した。
[主要評価項目]24ヵ月間での新規椎体骨折(検証的な解析項目)
[副次評価項目]24ヵ月間での臨床骨折(非椎体骨折)発生率
6、12、24ヵ月、最終時の腰椎骨密度、大腿骨骨密度(近位部 total)骨代謝マーカー 等
解析計画:
骨折抑制効果は Kaplan-Meier 推定法に基づいたlog-rank 検定のほか、Cox 回帰モデルによるハザード比と95%信頼区間を算出した。
副次的解析として、評価期間別(0から 6、12、18、24ヵ月後)の骨折割合、相対リスク、信頼区間を算出しFisherの直接確率検定で解析した。また、骨密度の変化率はt検定で解析し、骨代謝マーカーに及ぼす影響については経時的変化の要約を行った。
副作用
副作用(臨床検査値の異常を含む)はリクラスト群では333 例中197 例(59.2%)、プラセボ群では332 例中40 例(12.0%)に認められた。主な副作用はリクラスト群では、発熱131 例(39.3%)、関節痛36 例(10.8%)、筋肉痛27 例(8.1%)、倦怠感26 例(7.8%)、インフルエンザ様疾患23 例(6.9%)、血中カルシウム減少21 例(6.3%)、頭痛20 例(6.0%)等、プラセボ群では発熱9 例(2.7%)、倦怠感6 例(1.8%)等であった。重篤な副作用はリクラスト群で肺炎1例、プラセボ群で心房細動が1 例認められ、副作用による死亡例は両群で認められなかった。投与中止に至った副作用はプラセボ群の1例に認められた。































 骨粗鬆症領域情報
骨粗鬆症領域情報