臨床試験成績
「警告、禁忌を含む使用上の注意」等は添付文書をご参照ください。
複数の海外エビデンス
海外第Ⅲ相臨床試験(HORIZON-PFT)
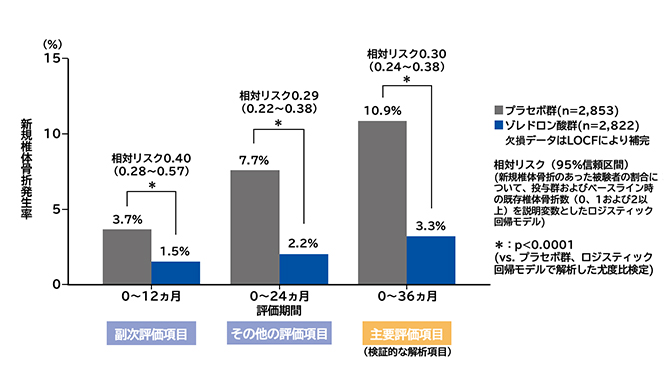
投与後36ヵ月間の新規椎体骨折の発生率はゾレドロン酸群で3.3%、プラセボ群で10.9%であり、ゾレドロン酸はプラセボに対して新規椎体骨折の発生を有意に抑制しました(p<0.0001、尤度比検定)。相対リスク減少率は70%でした(相対リスク0.30、95%信頼区間0.24~0.38、ロジスティック回帰モデル※1)。また、評価期間ごとの新規椎体骨折発生率は、すべての評価期間でゾレドロン酸群はプラセボ群に対して低値を示しました。
※1:新規椎体骨折のあった被験者の割合について、投与群及びベースライン時の既存椎体骨折数(0、1及び2以上)を説明変数としたロジスティック回帰モデル
新規椎体骨折発生率
安全性
副作用(臨床検査値の異常を含む)はゾレドロン酸群で3,862例中1,749例(45.3%)、プラセボ群で 3,852例中660例(17.1%)でした。主な副作用はゾレドロン酸群で発熱617例(16.0%)、筋肉痛362例(9.4%)、インフルエンザ様疾患301例(7.8%)、関節痛261例(6.8%)、頭痛250例(6.5%)等、プラセボ 群で発熱78例(2.0%)、頭痛73例(1.9%)、筋肉痛62例(1.6%)、インフルエンザ様疾患59例(1.5%)、関節痛52例(1.4%)等でした。 なお、重篤な副作用はゾレドロン酸群31例(膀胱癌2例、徐脈性不整脈、失神、薬物過敏症、大葉性肺炎、幻覚/筋炎/横紋筋融解症、発熱/頭痛/筋肉痛、背部痛/浮動性めまい、開口障害、筋骨格痛/悪寒/発熱/無力症、虚血性脳卒中、高熱、腎嚢胞、肝酵素上昇、緑内障、関節痛/発熱、急性膵炎、口の錯感覚/洞性頻脈、大腿骨骨折、筋肉痛、疼痛、関節痛/高熱、甲状腺髄様癌、乳頭様甲状腺癌、背部痛/浮動性めまい/発熱/頭痛/筋肉痛/悪心/頸部痛/嘔吐/気道感染、発熱、慢性閉塞性肺疾患/インフルエンザ、有害事象、疼痛/無力症、腎クレアチニンクリアランス減少、各1例)、プラセボ群16例(脊椎圧迫骨折2例、意識消失、腎不全/尿路感染、股関節部骨折、骨炎、蛋白尿、歯肉腫脹、局所腫脹、大腿骨骨折、発熱/血液量減少性ショック、乳癌、失神、気管支炎、高血圧/腎不全、肺の悪性新生物、各1例)であり、因果関係の否定できない死亡例はゾレドロン酸群の1例(膀胱癌)でした。また、副作用による投与中止例はゾレドロン酸群では30例(腎クレアチニンクリアランス減少6例、ぶどう膜炎3例、四肢痛2例、インフルエンザ様疾患2例、関節痛2例、薬物過敏症、潮紅/低血圧、下痢/嘔吐/関節腫脹/神経痛、関節痛/疲労/発熱/頭痛/眼刺激/筋肉痛/悪心/意識レベルの低下/傾眠/回転性めまい、悪寒/悪心/疲労、開口障害、筋骨格痛/悪寒/発熱/無力症、肝酵素上昇、筋肉痛、紅斑、洞性頻脈、事象不明、骨痛/悪寒/疲労/多汗症/頭痛、悪寒/頭痛/悪心、疼痛/無力症、各1例)、プラセボ群で16例(腎クレアチニンクリアランス減少6例、腎不全3例、腎機能障害3例、硬膜炎、股関節部骨折、熱感/、肺の悪性新生物、各1例)でした。
| 目的 | 閉経後骨粗鬆症患者にゾレドロン酸5mgを点滴静脈内投与したときの有効性及び安全性を評価する。 |
|---|---|
| 試験デザイン | 国際共同、無作為化、層化、プラセボ対照、二重盲検、並行群間比較 |
| 対象 |
閉経後骨粗鬆症患者※17,736例
|
| 投与方法 |
ゾレドロン酸5mgまたはプラセボを1回15分以上かけて1年間隔で3回点滴静脈内投与し、3回目投与1年後までの3年間観察した。なお、全患者に毎日、カルシウム1,000~1,500mg/日及びビタミンD 400~1,200IU/日を投与した。 無作為化以前の骨粗鬆症治療薬(通常治療※3)の使用歴に基づき、2つのStratumに層化
|
| 評価項目 |
|
| 解析計画 | 36ヵ月間での新規椎体骨折発生率は、ロジスティック回帰モデルで解析した尤度比検定のほか、95%信頼区間の算出で解析した。大腿骨近位部骨折の初発までの期間はKaplan-Meier推定法に基づいたlog-rank検定のほか、Cox比例ハザード回帰モデルによるハザード比と95%信頼区間の算出で解析した。また、骨密度増加効果は、三元配置分散分析で解析した。 |
※1:2個以上の軽度または1個以上の中等度の椎体骨折を有し、大腿骨頸部骨密度のTスコアが-1.5以下、あるいは、既存椎体骨折の有無にかかわらず大腿骨頸部骨密度のTスコアが-2.5以下の患者
※2:ITT集団:無作為化された患者のうち、モニタリングおよびデータレビューによりデータの信頼性に問題があることが確認された医療機関の患者29例を除く全患者
mITT集団:ITT集団のうち、各年の来院時に1個以上の評価可能な椎体を有するStratum Iの患者
※3:「通常治療」は、ホルモン補充療法(HRT)、選択的エストロゲン受容体モジュレーター(SERMs、ラロキシフェン等)、カルシトニン、チボロン、タモキシフェン、デヒドロエピアンドロステロン、イプリフラボン及びメドロキシプロゲステロン等による薬物治療を含み、ゾレドロン酸以外のビスホスホネート製剤は除外する。
承認時評価資料:閉経後骨粗鬆症患者での海外第Ⅲ相臨床試験(H2301試験:HORIZON-PFT)
Black DM, et al. N Engl J Med. 2007; 356(18): 1809-22.
本試験はノバルティスファーマAGの支援により実施された。
海外第Ⅲ相臨床試験(HORIZON-RFT)
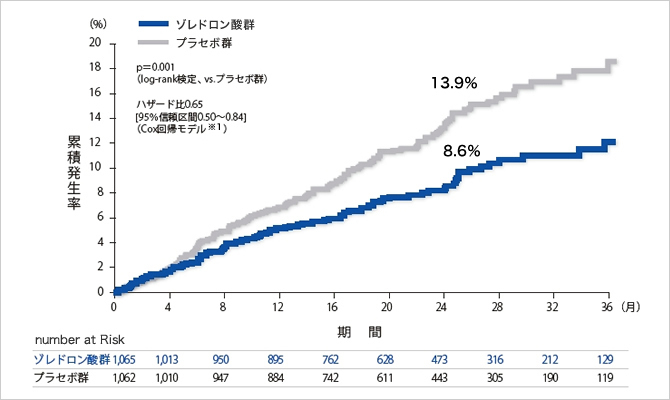
大腿骨近位部骨折術後患者におけるKaplan-Meier推定法に基づく24ヵ月時点の臨床骨折の累積発生率はゾレドロン酸群で8.6%、プラセボ群で13.9%であり、ゾレドロン酸はプラセボに対して新規臨床骨折を有意に抑制しました(p=0.001、log-rank検定、ハザード比0.65、95%信頼区間0.50~0.84、Cox回帰モデル※1)。
※1:投与群を因子とするCox比例ハザード回帰モデル
新規臨床骨折発生率
安全性
有害事象はゾレドロン酸群で1,054例中867例(82.3%)、プラセボ群で1,057例中852例(80.6%)でした。 主な有害事象はゾレドロン酸群で関節痛189例(17.9%)、尿路感染112例(10.6%)、背部痛109例(10.3%)、転倒102例(9.7%)、発熱92例(8.7%)等、プラセボ群で関節痛193例(18.3%)、転倒120例(11.4%)、背部痛115例(10.9%)、尿路感染101例(9.6%)等でした。 重篤な有害事象はゾレドロン酸群404例(38.3%)、プラセボ群436例(41.3%)でした。 主な重篤な有害事象はゾレドロン酸群で肺炎33例、処置後合併症30例、関節痛25例、脳血管発作21例等、プラセボ群で肺炎36例、処置後合併症30例、関節痛24例、大腿骨近位部骨折22例等でした。 死亡はゾレドロン酸群101例、プラセボ群で141例でした。 有害事象による投与中止例はゾレドロン酸群56例(腎クレアチニンクリアランスの減少5例、腎不全5例、敗血症4例、心不全3例、全身健康状態悪化3例等)、プラセボ群50例(腎クレアチニンクリアランスの減少4例、脳血管発作4例、心肺停止4例、心停止3例等)でした。
| 試験名 | HORIZON-RFT(Health Outcomes and Reduced Incidence with Zoledoronic Acid Once Yearly Recurrent Fracture Trial) (海外第Ⅲ相臨床試験:L2310試験) |
|---|---|
| 試験デザイン | 国際共同、無作為化、プラセボ対照、二重盲検、並行群間比較試験 |
| 目的 | 非外傷性大腿骨近位部骨折の外科的手術後の男女に、ゾレドロン酸5mgを年1回投与することにより、プラセボを投与する場合と比較して、臨床骨折(大腿骨近位部骨折後の二次骨折:投与開始後のすべての骨粗鬆症性骨折)の発生率が有意に低下することを検証する(両群ともにビタミンDおよびカルシウムの補給下) |
| 対象 | 非外傷性大腿骨近位部骨折の外科的手術後90日以内の患者2,127例 |
| 方法 | ゾレドロン酸5mgまたはプラセボを年1回静脈内点滴投与する。骨折発生数が効果の差を示す必要数(211件)に達するまで、あるいは最後の被験者が、36ヵ月後の来院を行うまでを試験期間とした。 |
| 主要評価項目 | 臨床骨折の初発までの期間(検証的な解析項目) |
| 副次評価項目 |
12、24、36ヵ月後の骨密度(非骨折側の大腿骨近位部total、大腿骨頸部) 非椎体骨折の初発までの期間 大腿骨近位部骨折の初発まで期間 臨床椎体骨折の初発までの期間 等 |
| 安全性評価項目 | 累積死亡率、有害事象 |
| 解析計画 | 測定された36ヶ月間のデータの内、骨折の評価は2群間の生存関数を比較するためのlog-rank検定を用いて24か月間で評価した。ハザード比とその95%信頼区間およびp値に関して、投与群を因子とするCox比例ハザード回帰モデルを用いて算出した。また、骨密度は測定された36ヶ月間のデータにより投与群および地域を説明変数とする二元配置分散分析モデルを用いて評価した。差の最小二乗平均値とその95%信頼区間として表した。 |
| 基礎治療 | 初回の治験薬投与に先立ち、負荷用量(50,000-125,000IU) ビタミンD2またはビタミンD3を1回投与した。 その後、維持用量のビタミンD(800~1,200 IU/日)およびカルシウム(1,000~1,500 mg/日)を14日間以上投与した。 試験中も、維持用量のビタミンDおよびカルシウムを毎日投与した。 |
| 対処薬 | インフルエンザ様疾患の発現が想定されるため、全被験者に対し、初回試験薬投与時、および必要があれば投与後72時間に、アセトアミノフェンを投与した。 |
Lyles KW, et al.: N Engl J Med 2007; 357: 1799-1809.
本試験はノバルティスファーマAGの支援により実施された。
ステロイド性骨粗鬆症に対する試験(O2306試験)
腰椎骨密度変化率
ステロイド性骨粗鬆症患者(治療部分集団)の投与12ヵ月後における腰椎(L1-4)骨密度のベースラインからの変化率において、ゾレドロン酸のリセドロン酸に対する非劣性が検証され、さらに優越性も示されました。
腰椎骨密度変化率
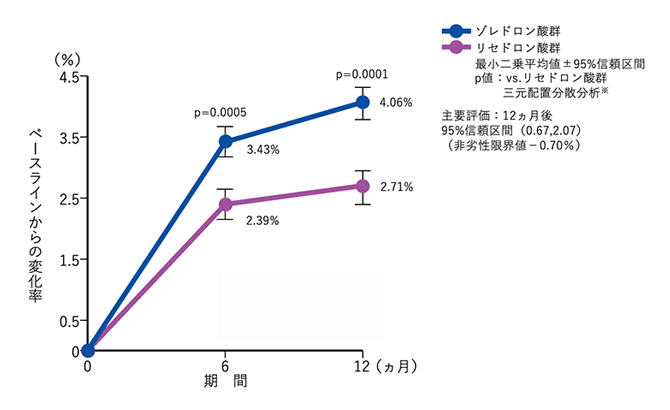
※:投与群、性別、地域を説明変数とする三元配置分散分析モデル
大腿骨頸部骨密度変化率
ステロイド性骨粗鬆症患者(治療部分集団)の投与12ヵ月後における大腿骨頸部骨密度のベースラインからの変化率において、有意差が認められた。
大腿骨頸部骨密度変化率
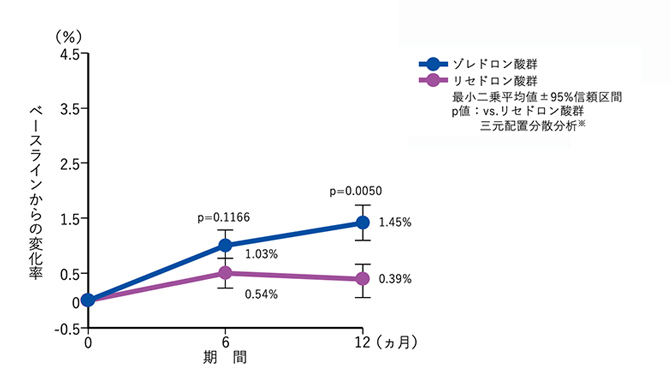
※:投与群、性別、地域を説明変数とする三元配置分散分析モデル
安全性
有害事象はゾレドロン酸群で416例中322例(77.4%)、リセドロン酸群で417例中279例(66.9%)でした。主な有害事象はゾレドロン酸群で発熱53例(12.7%)、関節痛41例(9.9%)、吐気40例(9.6%)、筋肉痛38例(9.1%)等、リセドロン酸群で吐気35例(8.4%)、関節痛31例(7.4%)、背部痛26例(6.2%)、関節リウマチ21例(5.0%)等でした。重篤な有害事象はゾレドロン酸群76例(18.3%)、リセドロン酸群77例(18.5%)であり、このうち、因果関係の否定できない有害事象はゾレドロン酸群7例(急性腎不全、発熱、悪寒、筋痙縮等)、 リセドロン酸群1例(十二指腸潰瘍)でした。因果関係の否定できない死亡は両群で認められませんでした。 投与中止に至った有害事象はゾレドロン酸群で33例、リセドロン酸群で22例でした。
| 試験名 | 海外第Ⅲ相臨床試験:O2306試験 |
|---|---|
| 試験デザイン | 国際共同、無作為化、層化、実薬対照、二重盲検、並行群間比較、非劣性試験 |
| 目的 | 男女骨粗鬆症患者(①および②)におけるゾレドロン酸群の12ヵ月後の腰椎骨密度変化率が、リセドロン酸群に劣らないことを検証する①治療部分集団(ステロイド投与3ヵ月超) ②予防部分集団(ステロイド投与3ヵ月以下) |
| 対象 | 18~85歳の男女、かつプレドニゾロン7.5mg/日以上の経口投与を受け、12ヵ月以上の 投与継続が予定されている患者 833例 (男性 265例、女性 568例) |
| 方法 | ゾレドロン酸群にはゾレドロン酸5mgを1回、15分以上20分未満で点滴静注、1年間観察 リセドロン酸群にはリセドロン酸5mgを1日1回、12ヵ月間経口投与それぞれ対応するプラセボを投与基礎治療として、すべての被験者にカルシウム1,000mg/日およびビタミンD 400~1,200IU/日を投与 |
| 主要評価項目 | ベースラインに対する12ヵ月後の腰椎骨密度の変化率(検証的な解析項目) |
| 副次評価項目 | ベースラインに対する6ヵ月後の腰椎骨密度の変化率、骨代謝マーカーの変化、 |
| 解析計画 |
|
わが国におけるリセドロン酸1日1回投与の用法・用量は「通常、成人にはリセドロン酸ナトリウムとして2.5mgを1日1回、起床時に十分量(約180mL)の水とともに経口投与する。」である。なお、リセドロン酸の国内での用量2.5mg/日と海外での用量5mg/日の臨床的有効性に類似性が認められている。
男性骨粗鬆症に対する臨床試験(M2309試験)
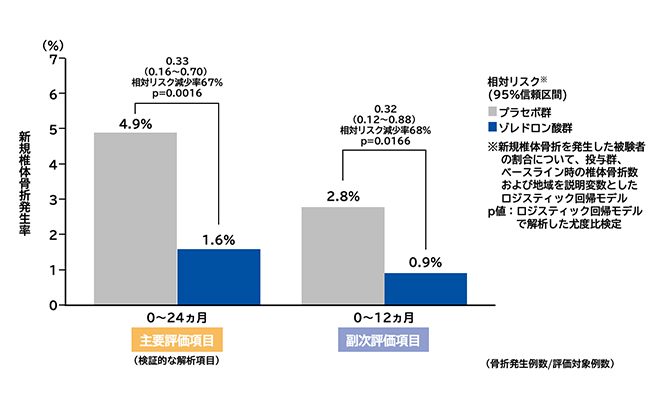
新規椎体骨折発生率
投与後24ヵ月間の新規椎体骨折の発生率はゾレドロン酸群で1.6%、プラセボ群で4.9%であり、ゾレドロン酸はプラセボに対して新規椎体骨折の発生を有意に抑制しました(p=0.0016、尤度比検定)。相対リスク減少率は67%でした(95%信頼区間0.16~0.70、ロジスティック回帰モデル※1)。また、投与後12ヵ月間においてもゾレドロン酸はプラセボに対して新規椎体骨折の発生を有意に抑制しました(p=0.0166、尤度比検定)。相対リスク減少率は68%でした(95%信頼区間0.12~0.88、ロジスティック回帰モデル※1)。
※1:新規椎体骨折を発生した被験者の割合について、投与群、ベースライン時の椎体骨折数及び地域を説明変数としたロジスティック回帰モデル
新規椎体骨折発生率
安全性
有害事象はゾレドロン酸群で588例中534例(90.8%)、プラセボ群で611例中466例(76.3%)でした。 主な有害事象はゾレドロン酸群で発熱143例(24.3%)、筋肉痛129例(21.9%)、関節痛123例(20.9%)、背部痛84例(14.3%)、頭痛82例(13.9%)等、プラセボ群で背部痛74例(12.1%)、関節痛68例(11.1%)、鼻咽頭炎49例(8.0%)、高血圧46例(7.5%)、外傷性骨折36例(5.9%)等でした。 重篤な有害事象はゾレドロン酸群149例(25.3%)、プラセボ群154例(25.2%)であり、因果関係が否定できない重篤な有害事象は、ゾレドロン酸群で6例(心房細動3例、脳血管障害1例、失神1例及び薬物有害反応1例)、プラセボ群で4例(心房細動、うっ血性心不全、アルコール誘導持続性認知症、痙攣及び網膜剥離、いずれも1例)でした。 死亡例はゾレドロン酸群15例、プラセボ群18例であり、主な死因は急性心筋梗塞(それぞれ2例及び1例)、心停止(1例及び2例)、肺炎(1例及び2例)等でした。 また、有害事象による投与中止例はゾレドロン酸群23例、プラセボ群23例でした。
| 目的 | 新規椎体骨折を24ヵ月間に1個以上発生した被験者の割合を指標とし、ゾレドロン酸5mg年1回、2回投与のプラセボに対する優越性を検証する |
|---|---|
| 対象 |
男性骨粗鬆症患者 1,199例
|
| 方法 |
国際共同、無作為化、プラセボ対照、二重盲検、並行群間比較試験。 ゾレドロン酸5mgまたはプラセボを年1回15分以上かけて1年間隔で2回点滴静脈内投与し、2年間観察した。 なお、全患者にカルシウム1,000~1,500mg/日およびビタミンD800~1,200IU/日を投与した。
|
| 主要評価項目 | ベースラインに対する12ヵ月後の腰椎骨密度の変化率(検証的な解析項目) |
| 副次評価項目 | ベースラインに対する6ヵ月後の腰椎骨密度の変化率、骨代謝マーカーの変化、 |
| 解析計画 | 新規椎体骨折発生率は、ロジスティック回帰モデルで解析した尤度比検定のほか、相対リスクと95%信頼区間の算出で解析した。 |
Boonen S, et al. N Engl J Med. 2012; 367(18): 1714-23.
本試験はノバルティスファーマAGの支援により実施された。































 骨粗鬆症領域情報
骨粗鬆症領域情報