臨床試験成績
「警告、禁忌を含む使用上の注意」等は添付文書をご参照ください。
国内第Ⅲ相臨床試験(ZONE Study)
骨密度の変化
腰椎骨密度(L2-4)変化率
リクラスト群の腰椎(L2-4)骨密度のベースラインからの変化率は、投与6、12、24ヵ月後のいずれの評価時点においてもプラセボ群に対して有意な増加を認めました(いずれの時点もp<0.0001、t検定)。
腰椎骨密度(L2-4)変化率の推移
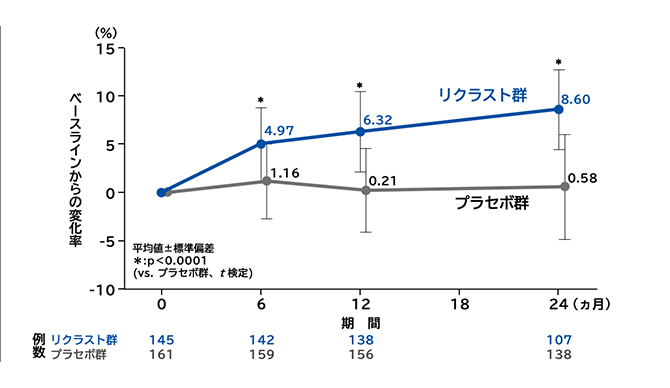
大腿骨近位部total骨密度変化率
リクラスト群の大腿骨近位部total骨密度のベースラインからの変化率は、投与6、12、24ヵ月後のいずれの評価時点においてもプラセボ群に対して有意な増加を認めました(いずれの時点もp<0.0001、t検定)。
大腿骨近位部total骨密度変化率の推移
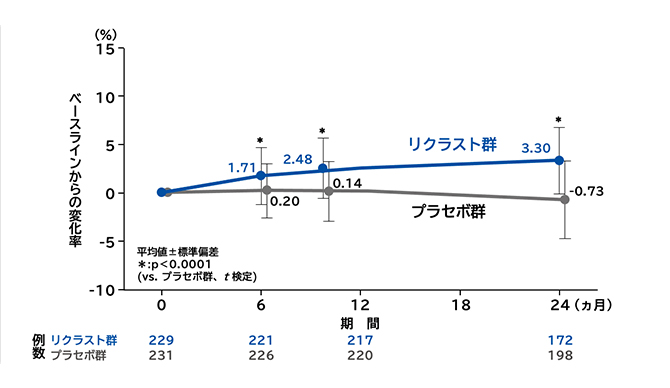
大腿骨頸部骨密度変化率
リクラスト群の大腿骨頸部骨密度のベースラインからの変化率は、投与6、12、24ヵ月後のいずれの評価時点においてもプラセボ群に対して有意な増加を認めました(6ヵ月後はp=0.0002、12ヵ月および24ヵ月後はp<0.0001、t検定)。
大腿骨頸部骨密度変化率の推移
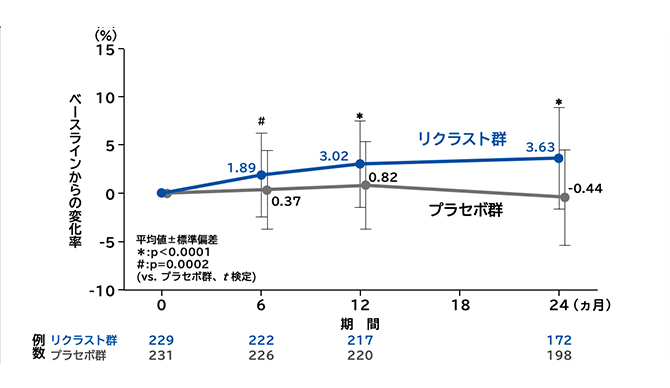
安全性
副作用(臨床検査値の異常を含む)はリクラスト群では333例中197例(59.2%)、プラセボ群では332例中 40例(12.0%)に認められました。主な副作用はリクラスト群では、発熱131例(39.3%)、関節痛36例(10.8%)、筋肉痛27例(8.1%)、26例(7.8%)、インフルエンザ様疾患23例(6.9%)、血中カルシウム 減少21例(6.3%)、頭痛20例(6.0%)等、プラセボ群では発熱9例(2.7%)、6例(1.8%)等でした。重篤な副作用はリクラスト群で肺炎1例、プラセボ群で心房細動が1例認められ、副作用による死亡例は両群で認められませんでした。投与中止に至った副作用はプラセボ群の1例に認められました。
| 目的 | 日本人原発性骨粗鬆症患者にリクラスト5mgを点滴静脈内投与したときの有効性を検証し、安全性について検討する。 |
|---|---|
| 試験デザイン | 多施設共同、無作為化、プラセボ対照、二重盲検、並行群間比較 |
| 対象 |
日本人原発性骨粗鬆症外来患者665例(女性625例、男性40例)
|
| 投与方法 | リクラスト5mgまたはプラセボを1回15分以上かけて1年間隔で2回点滴静脈内投与し、2回目投与1年後までの2年間観察した。なお、全患者に同意取得時から毎日、カルシウム610mg/日、ビタミンD3 400IU/日及びマグネシウム30mg/日を投与した。 |
| 評価項目 |
|
| 解析計画 | 骨折抑制効果はKaplan-Meier推定法に基づいたlog-rank検定のほか、Cox回帰モデルによるハザード比と95%信頼区間の算出で解析し、さらに主要評価項目は相対リスク減少率の算出とFisherの直接確率検定で解析した。また、骨密度増加効果は検定で解析し、骨代謝マーカーに及ぼす影響については経時的変化の要約を行った。 |
承認時評価資料:日本人原発性骨粗鬆症患者での第Ⅲ相臨床試験(AK156-Ⅲ-1試験:ZONE Study)
Nakamura T. et al. Osteoporos Int. 2017; 2 8(1): 389-98.
本試験は旭化成ファーマ株式会社の支援により実施された。































 骨粗鬆症領域情報
骨粗鬆症領域情報