有効性
「警告、禁忌を含む使用上の注意」等は添付文書をご参照ください。
本剤は、国内第Ⅱ/Ⅲ相ブリッジング試験及び海外第Ⅲ相ブリッジング対象試験に基づき、海外臨床試験データを日本人に外挿することが可能であると判断され、臨床データパッケージに基づいて承認されました。このため、一部承認用法・用量と異なる成績が含まれますが、承認時評価資料のため掲載します。
国内第Ⅱ/Ⅲ相臨床試験[KAKEHASI(EFC14059)試験]
MTXで効果不十分な関節リウマチ患者を対象としたMTX併用試験
試験概要
■目的
■試験デザイン
多施設共同、無作為化、プラセボ対照二重盲検(24週間)、並行群間比較試験(国内第Ⅱ/Ⅲ相臨床試験、52週間)
■対象
MTXで効果不十分な中等度から重度の活動性RA患者242例
■投与方法
以下に示す4つの投与群に2:2:1:1の比率で無作為に割り付け、ケブザラ又はプラセボを2週間に1回、52週間皮下投与した。また、すべての患者に基礎治療としてMTXを投与した。ただし、24週間のプラセボ対照二重盲検期間終了後、プラセボ投与群は二重盲検下でケブザラ150mg又は200mgが投与された。

- 救済治療:
- 16週以降、効果不十分の定義に該当する患者は、ケブザラ200mgの2週間に1回皮下投与での救済治療を可能とした。[腫脹関節数又は圧痛関節数の改善が2回連続して(少なくとも4週間あけて)ベースラインから20%未満]
■評価項目
- 主要評価項目:
- ACR20改善率(24週時)(検証的な解析項目)
- 副次評価項目:
- 重篤な有害事象、特に注目すべき有害事象を含む有害事象、臨床検査値等
- 探索的評価項目 注):
-
ACR20改善率(12週時)、ACR50/70改善率
ベースラインからのDAS28-CRP変化量及び推移、DAS28-CRP寛解率
ベースラインからのSDAI変化量、SDAI寛解率
ベースラインからのCDAI変化量、CDAI寛解率
ベースラインからのHAQ-DI変化量、HAQ-DIレスポンダーの割合等
注)その他の有効性評価項目を探索的評価項目とした。
■解析計画
例数は、主要評価項目の優越性を検証できるよう設計した。
主要な有効性解析対象集団はmodified intent-to-treat(mITT)集団とした。
主要評価項目は、生物学的製剤使用歴の有無及び体重(55kg未満、55kg以上)を層別因子として両側Cochran-Mantel-Haenszel検定によって解析を行った。 Hochbergの手順に従い、両用量群ではp値が0.05未満の場合、いずれかの用量群ではもう一方の用量群のp値に関わらずp値が0.025未満の場合に統計学的に有意であるとした。
探索的な有効性評価項目(24週時)の2値変数については、主要評価項目と同様に解析した。連続変数(24週時)については、ベースラインからの変化量をmixed model repeated measures(MMRM)を用いて解析した。投与群、生物学的製剤使用歴、スクリーニング時の体重(55kg未満、55kg以上)、時点及び投与群と時点の交互作用を固定効果、ベースラインを共変量としたモデルを用いて、ベースラインからの変化量についてケブザラの各用量群とプラセボ群との群間差を検定した。ケブザラの用量群ごとに、プラセボ群に対する最小二乗平均値の群間差、95%信頼区間(CI)及びp値を算出した。
患者背景
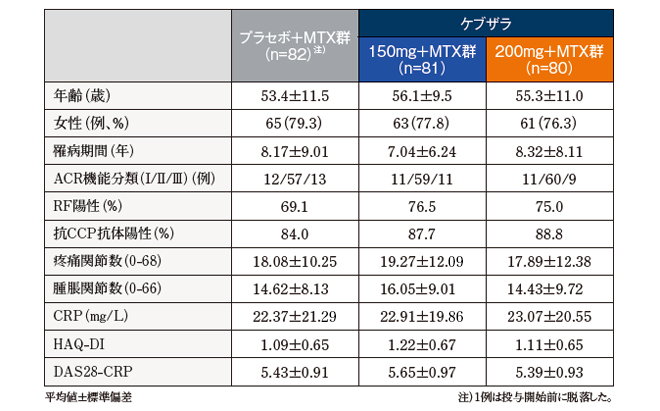
用語解説
ACR改善率(ACR20,ACR50,ACR70):
ACRコアセット7項目(圧痛関節数、腫脹関節数、患者による疼痛評価、患者全般活動性評価、医師による全般活動性評価、身体機能評価、急性期反応物質(ESR、CRP))のうち、圧痛関節数及び腫脹関節数ともにそれぞれ20%、50%、70%以上改善し、またその他の5評価項目のうち3項目以上で20%、50%、70%以上改善した症例の割合。
DAS28:
DAS28ESR=0.56×√(圧痛関節数)+0.28×√(腫脹関節数)+0.7×LN(ESR)+0.014×(VAS 注)による患者の全般評価)
DAS28CRP=0.56×√(圧痛関節数)+0.28×√(腫脹関節数)+0.36×LN((CRP)×10)+0.014×(VASによる患者の全般評価)+0.96
SDAI(Simplified Disease Activity Index):
SDAI=圧痛関節数+腫脹関節数+VASによる患者の全般評価+VASによる医師の全般評価+CRP
CDAI(Clinical Disease Activity Index):
CDAI=圧痛関節数+腫脹関節数+VASによる患者の全般評価+VASによる医師の全般評価
注) Visual Analog Scale:
視覚的評価スケール(現在の状態が0〜100mmのどの位置にあるかを示す方法)
(1)ACR20改善率(12週時[探索的評価項目]、24週時[主要評価項目])
ACR20改善率は、以下のような推移を示した。24週時のACR20改善率は、ケブザラ150mg+MTX群で67.9%、ケブザラ200mg+MTX群で57.5%、プラセボ+MTX群で14.8%であり、プラセボ+MTX群に対してケブザラ2用量群のいずれにおいても優越性が検証された。
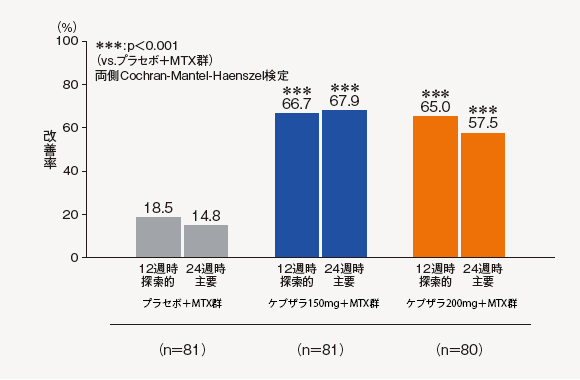
中止(救済治療を含む)など判定不能な患者について、それ以降の時点には効果不十分症例として補完した。
(2)ACR50改善率[探索的評価項目]
24週時のACR50改善率は、ケブザラ150mg+MTX群で43.2%、ケブザラ200mg+MTX群で38.8%、プラセボ+MTX群で9.9%であり、プラセボ+MTX群に対してケブザラ2用量群のいずれにおいても有意差が認められた。
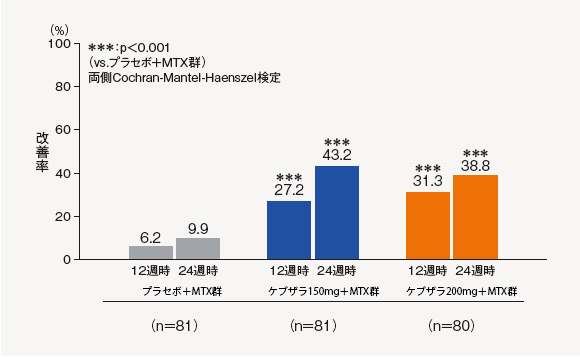
中止(救済治療を含む)など判定不能な患者について、それ以降の時点には効果不十分症例として補完した。
(3)ACR70改善率[探索的評価項目]
24週時のACR70改善率は、ケブザラ150mg+MTX群で18.5%、ケブザラ200mg+MTX群で15.0%、プラセボ+MTX群で3.7%であり、プラセボ+MTX群に対してケブザラ2用量群のいずれにおいても有意差が認められた。
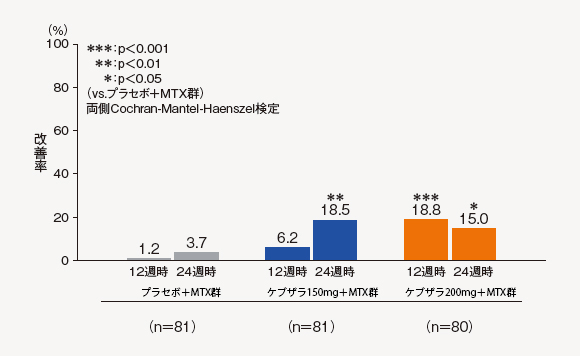
中止(救済治療を含む)など判定不能な患者について、それ以降の時点には効果不十分症例として補完した。
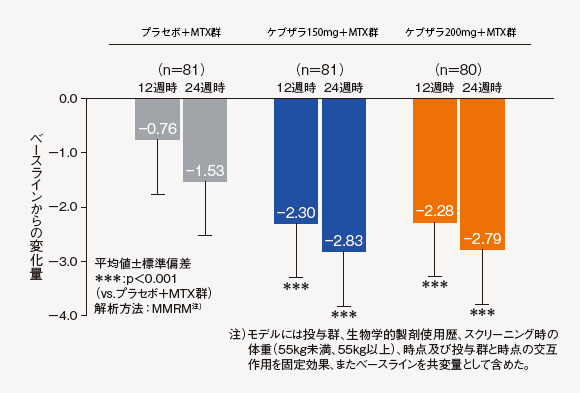
(4)DAS28-CRP変化量[探索的評価項目]
12週時及び24週時におけるべースラインからのDAS28-CRP変化量は、ケブザラ2用量群のいずれにおいてもプラセボ+MTX群に対して有意差が認められた。
(5)DAS28-CRP変化量の推移[探索的評価項目]
ベースラインからのDAS28-CRP変化量は、以下の通りであった。
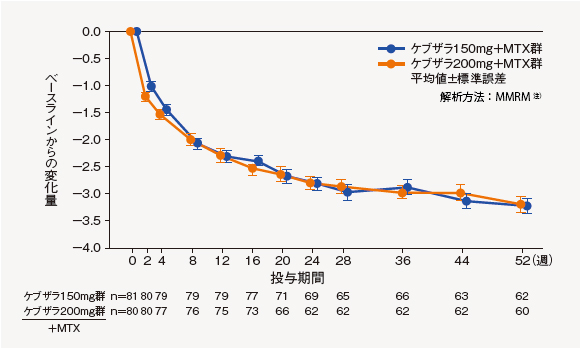
注)モデルには投与群、生物学的製剤使用歴、スクリーニング時の体重(55kg未満、55kg以上)、時点及び投与群と時点の交互作用を固定効果、またベースラインを共変量として含めた。
(6)DAS28-CRP寛解率[探索的評価項目]
12週時及び24週時におけるDAS28-CRP寛解の基準(2.6未満)に達した患者の割合は、ケブザラ2用量群のいずれにおいてもプラセボ+MTX群に対して有意差が認められ、ケブザラ200mg+MTX群では12週時に33.8%、24週時に40.0%であった。
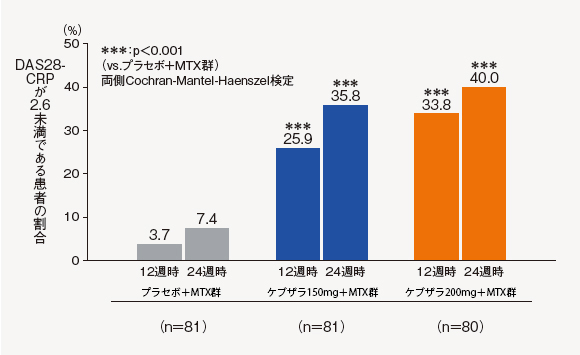
中止(救済治療を含む)など判定不能な患者について、それ以降の時点には効果不十分症例として補完した。
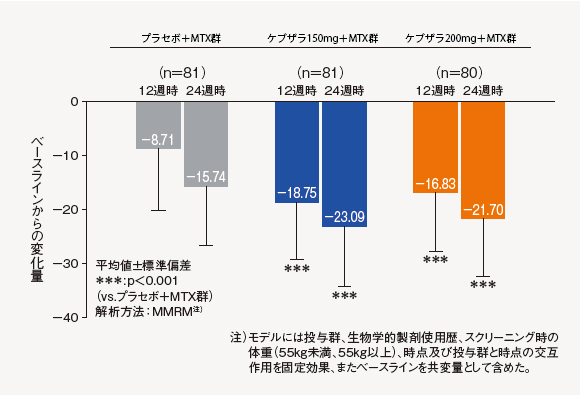
(7)SDAI変化量[探索的評価項目]
12週時及び24週時におけるベースラインからのSDAI変化量は、ケブザラ2用量群のいずれにおいてもプラセボ+MTX群に対して有意差が認められた。
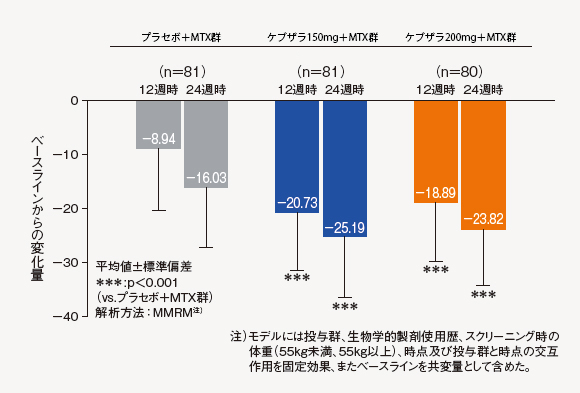
(8)SDAI寬解率[探索的評価項目]
SDAI寛解の基準(3.3以下)に達した患者の割合は、ケブザラ200mg+MTX群では12週時に8.8%、24週時に12.5%に達し、プラセボ+MTX群に対して有意差が認められた。
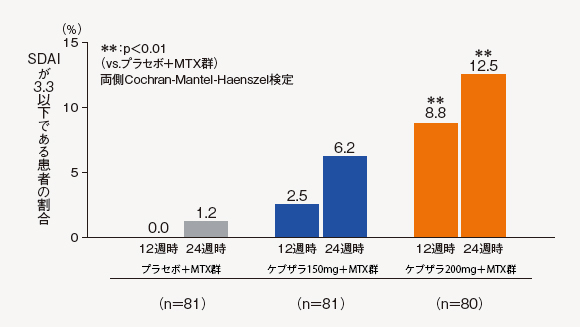
中止(救済治療を含む)など判定不能な患者について、それ以降の時点には効果不十分症例として補完した。
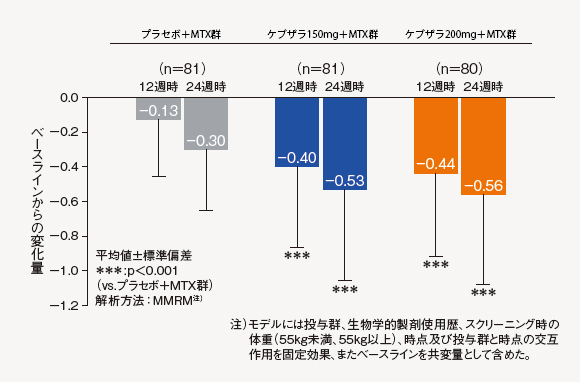
(9)CDAI変化量[探索的評価項目]
12週時及び24週時におけるベースラインからのCDAI変化量は、ケブザラ2用量群のいずれにおいてもプラセボ+MTX群に対して有意差が認められた。
(10)CDAI寬解率[探索的評価項目]
CDAI寛解の基準(2.8以下)に達した患者の割合は、ケブザラ200mg+MTX群では12週時に6.3%、24週時に10.0%に達し、プラセボ+MTX群に対して有意差が認められた。
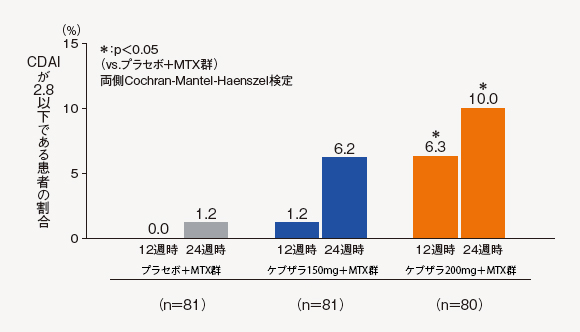
中止(救済治療を含む)など判定不能な患者について、それ以降の時点には効果不十分症例として補完した。
(11)HAQ-DI変化量[探索的評価項目]
12週時及び24週時におけるべースラインからのHAQ-DI変化量は、ケブザラ2用量群のいずれにおいてもプラセボ+MTX群に対して有意差が認められた。
(12)HAQ-DIレスポンダーの割合[探索的評価項目]
12週時および24週時におけるHAQ-DIが0.3以上低下した患者(レスポンダー)の割合は、ケブザラ2用量群のいずれにおいてもプラセボ+MTX群に対して有意差が認められた。
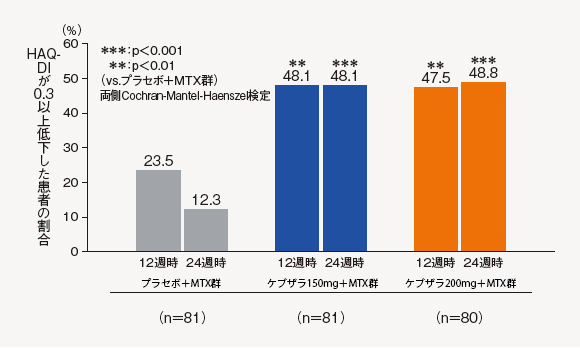
中止(救済治療を含む)など判定不能な患者について、それ以降の時点には効果不十分症例として補完した。
(13)安全性[副次評価項目]
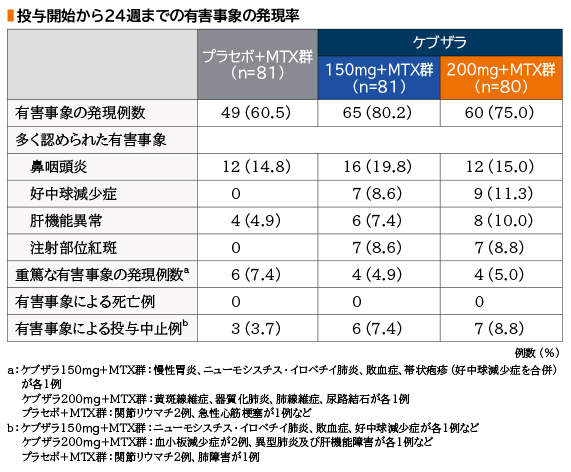
投与開始から24週までの有害事象の発現率は、ケブザラ150mg+MTX群で80.2%(65/81例)、200mg+MTX群で75.0%(60/80例)、プラセボ+MTX群で60.5%(49/81例)であった。
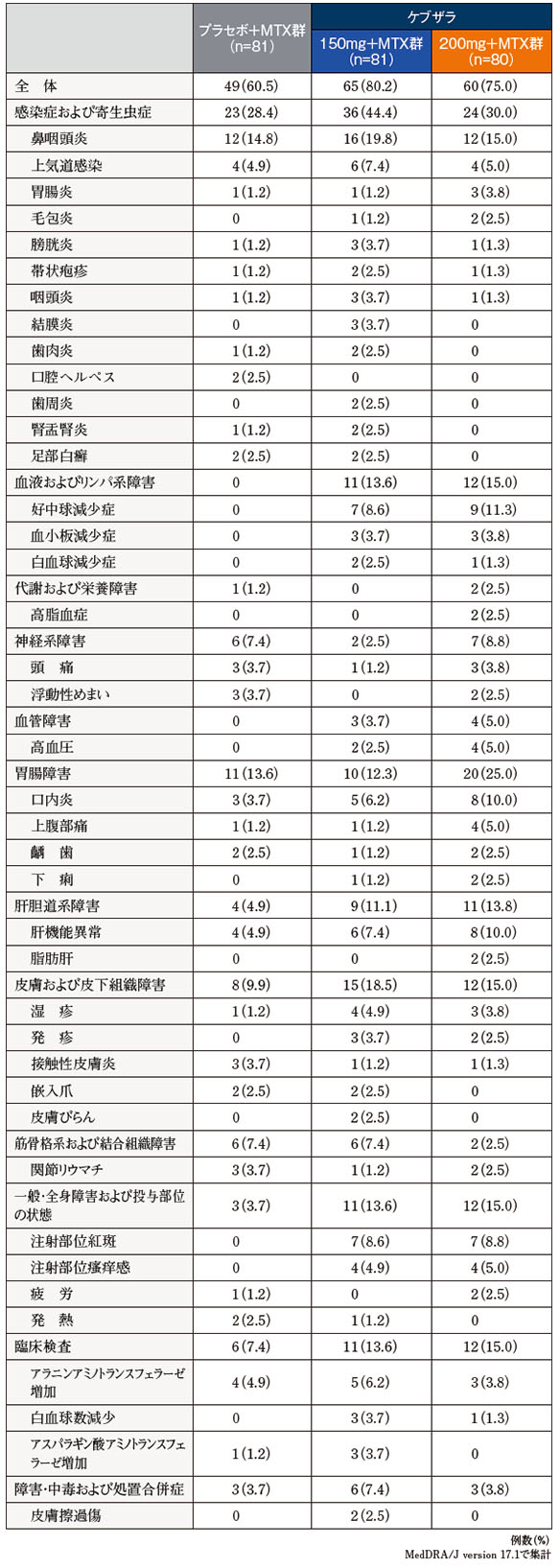
ケブザラ各用量群で多く認められた有害事象は、鼻咽頭炎がケブザラ150mg+MTX群で19.8%(16/81例)、200mg+MTX群で15.0%(12/80例)、好中球減少症が150mg+MTX群で8.6%(7/81例)、200mg+MTX群で11.3%(9/80例)、肝機能異常が150mg+MTX群で7.4%(6/81例)、200mg+MTX群で10.0%(8/80例)、注射部位紅斑が150mg+MTX群で8.6%(7/81例)、200mg+MTX群で8.8%(7/80例)であった。また、プラセボ+MTX群の主な有害事象は、鼻咽頭炎14.8%(12/81例)、上気道感染、肝機能異常、ALT増加がそれぞれ4.9%(4/81例)であった。
重篤な有害事象は、ケブザラ150mg+MTX群で4.9%(4/81例)、200mg+MTX群で5.0%(4/80例)、プラセボ+MTX群で7.4%(6/81例)に認められた。内訳は、ケブザラ150mg+MTX群で慢性胃炎、ニューモシスチス・イロベチイ肺炎、敗血症、帯状疱疹(好中球減少症を合併)が各1例、200mg+MTX群で黄斑線維症、器質化肺炎、肺線維症、尿路結石が各1例、プラセボ+MTX群で関節リウマチ2例、急性心筋梗塞が1例などであった。
投与中止に至った有害事象は、ケブザラ150mg+MTX群で7.4%(6/81例)、200mg+MTX群で8.8%(7/80例)、プラセボ+MTX群で3.7%(3/81例)に認められた。内訳は、ケブザラ150mg+MTX群でニューモシスチス・イロベチイ肺炎、敗血症、好中球減少症が各1例、200mg+MTX群で血小板減少症が2例、異型肺炎及び肝機能障害が各1例、プラセボ+MTX群で関節リウマチ2例、肺障害が1例などであった。
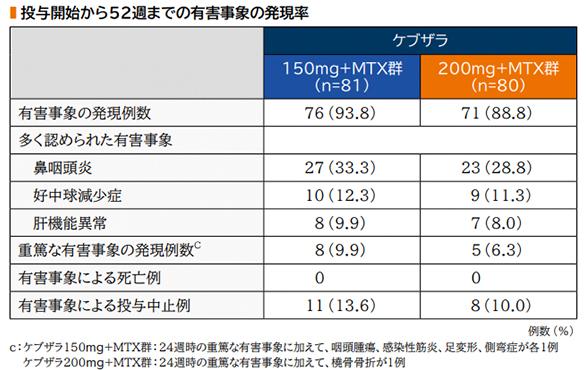
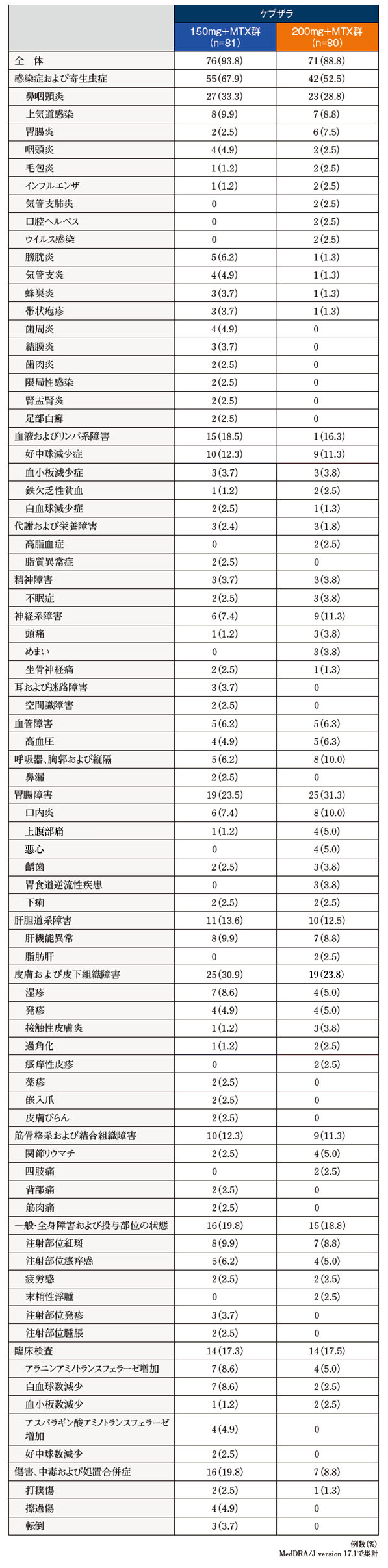
また、投与開始から52週までの有害事象の発現率はケブザラ150mg+MTX群で93.8%(76/81例)、200mg+MTX群で88.8%(71/80例)であり、内訳は鼻咽頭炎がそれぞれ33.3%(27/81例)、28.8%(23/80例)、好中球減少症がそれぞれ12.3%(10/81例)、11.3%(9/80例)、肝機能異常がそれぞれ9.9%(8/81例)、8.0%(7/80例)であった。
重篤な有害事象は、24週時の重篤な有害事象に加えてケブザラ150mg+MTX群で咽頭腫瘍、感染性筋炎、足変形、側弯症が各1例、200mg+MTX群で橈骨骨折が1例であった。
投与中止に至った有害事象は、ケブザラ150mg+MTX群で肝機能異常2例、蜂巣炎、ニューモシスチス・イロベチイ肺炎、感染性筋炎、敗血症、皮下組織膿瘍、咽頭膿瘍、白血球減少症及び好中球減少症が各1例、200mg+MTX群で血小板減少症2例、異型肺炎、白血球減少症、好中球減少症及び薬物性肝障害が各1例であった。
なお、本試験において死亡例は報告されなかった。
● 投与開始から24週までの有害事象
投与開始から24週までの有害事象の発現率
主な有害事象(24週)
いずれかの群で2%以上に認められた有害事象
● 投与開始から52週までの有害事象
投与開始から52週までの有害事象の発現率
主な有害事象(52週)
いずれかの群で2例以上に認められた有害事象
承認時評価資料,社内資料:国内第II/III相プラセボ対照二重盲検比較試験(メトトレキサート併用試験)[EFC14059試験]
Tanaka Y et al. Arthritis Res Ther. 2019; 21: 79-93.
本試験はSanofiの出資により実施された






























