有効性
「警告、禁忌を含む使用上の注意」等は添付文書をご参照ください。
本剤は、国内第Ⅱ/Ⅲ相ブリッジング試験及び海外第Ⅲ相ブリッジング対象試験に基づき、海外臨床試験データを日本人に外挿することが可能であると判断され、臨床データパッケージに基づいて承認されました。このため、一部承認用法・用量と異なる成績が含まれますが、承認時評価資料のため掲載します。
海外第Ⅲ相臨床試験[MOBILITY(EFC11072)試験]Part B(海外データ)
MTXで効果不十分な関節リウマチ患者を対象としたMTX併用試験[KAKEHASI(EFC14059試験)のブリッジング対象試験]
試験概要
■目的
■試験デザイン
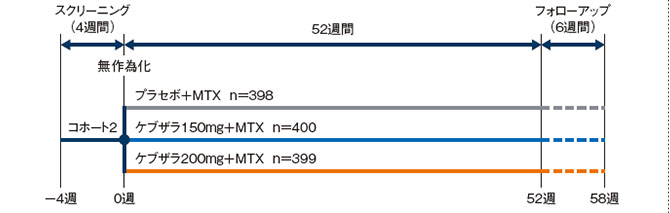
多施設共同、無作為化、プラセボ対照二重盲検、並行群間比較試験(海外第Ⅲ相臨床試験、52週間)
■対象
MTXで効果不十分な中等度から重度の活動性RA患者
有効性評価例数:1,197例
安全性評価例数:1,282例
注)海外第Ⅲ相臨床試験[MOBILITY(EFC11072)試験 Part B](海外データ)は、第Ⅱ相の用量設定試験をパートAとし、第Ⅲ相試験をパートBとした、2パートで構成した第Ⅱ/Ⅲ相試験であった。パートBでは患者を2つのコホートに登録し、コホート1の患者は第Ⅲ相試験の用量選択前にランダム化し(ケブザラ5用量群又はプラセボ群の6群)、コホート2の患者は用量選択後にランダム化した(“投与方法"参照)。
有効性評価例数はコホート2のみ、安全性評価例数にはコホート2にコホート1選択用量群を加えた。
■投与方法
- コホート2:
-
ケブザラ2用量群又はプラセボ群の3群に無作為に割り付け、いずれもMTX併用下で52週間皮下投与した。
・プラセボ2週間に1回 398例
・ケブザラ150mg2週間に1回 400例
・ケブザラ200mg2週間に1回 399例
- 救済治療:
- 16週以降、効果不十分の定義に該当する患者は、ケブザラ200mgの2週間に1回皮下投与での救済治療を可能とした。[腫脹関節数又は圧痛関節数の改善が2回連続して(少なくとも4週間あけて)ベースラインから20%未満]
■評価項目
- 主要評価項目:
-
ACR20改善率(24週時)
HAQ-DI変化量(16週時)
mTSS変化量(52週時)(いずれも検証的な解析項目)
- 副次評価項目:
-
Major Clinical Response(52週間の期間中において
24週間以上連続してACR70が持続していることと定義)
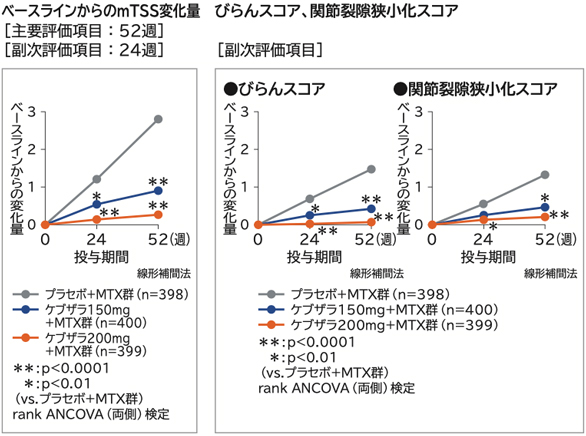
びらんスコア、関節裂隙狭小化スコア
関節の構造的損傷の進行がみられなかった患者の割合 等
- 安全性:
- 重篤な有害事象、特に注目すべき有害事象を含む有害事象、臨床検査値 等
■解析計画
試験の目標症例数はmTSSの評価項目においてプラセボ群に対する差を検出できるよう設計した。
有効性解析は、コホート2のintent-to-treat(ITT)集団を対象に実施した。安全性解析は、コホート2及びコホート1の選択された用量群の安全性解析対象集団を対象に実施した。
主要評価項目のうちACR20改善率(24週時)は、生物学的製剤の使用歴及び地域を層とした両側Cochran-Mantel-Haenszel検定によって解析を行った。ケブザラの用量群ごとに、プラセボ群に対するオッズ比のMantel-Haenszel推定値とその95%信頼区間(CI)を算出した。
ベースラインからのHAQ-DI変化量(16週時)は、ベースラインを共変量とし、投与群、地域、生物学的製剤の使用歴、時点(2〜16週の全評価時点)及び投与群と時点の交互作用を因子としたmixed model repeated measures(MMRM)を用いて解析した。ベースラインからのmTSS変化量(52週時)は、投与群、生物学的製剤の使用歴及び地域を因子とし、ベースラインで調整したrank ANCOVA(両側)検定により解析した。共変量であるmTSSのベースライン値及びmTSSの変化量について、生物学的製剤の使用歴及び地域ごとに標準化ランクを求めた。全体の第1種の過誤確率を5%に制御するため、主要評価項目3項目及び主要な副次評価項目1項目について、コホート2で用いた各用量群において多重性の調整を適用した。多重性の調整は、評価項目の記載順序の通りに閉手順を用いて行った。
副次評価項目であるMajor Clinical Response(52週時)及びその他の有効性評価項目の2値変数は、ACR20改善率と同じ手法で解析した。ケブザラの各用量群とプラセボ群との間でそれぞれ対比較し、ケブザラの用量群ごとにプラセボ群に対するオッズ比のMantel-Haenszel推定値とその95%信頼区間(CI)を算出した。副次評価項目のうちベースラインからの変化量などの連続変数については、投与群、地域、生物学的製剤の使用歴、時点及び投与群と時点の交互作用を固定効果、ベースラインを共変量とし、MMRMを用いて解析した。
患者背景
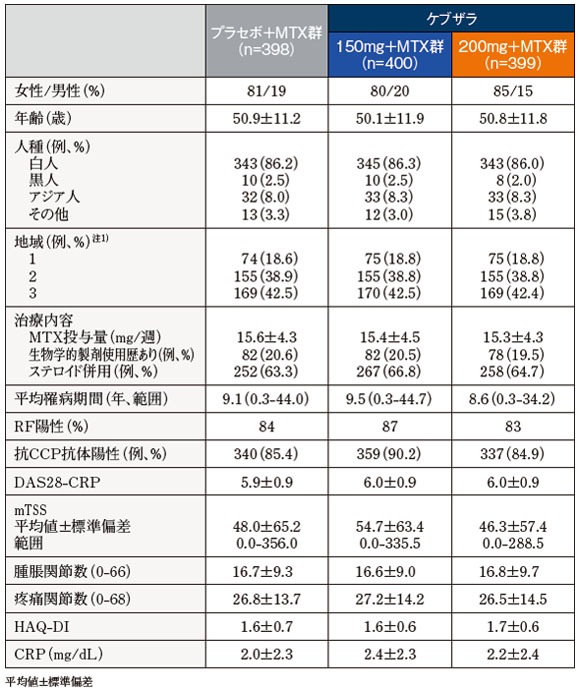
- 地域1:
- オーストリア、オーストラリア、ベルギー、カナダ、フィンランド、ドイツ、 ギリシャ、ハンガリー、ニュージーランド、ノルウェー、ポルトガル、スペイン、米国
- 地域2:
- アルゼンチン、ブラジル、チリ、コロンビア、メキシコ
- 地域3:
- ベラルーシ、エストニア、インド、マレーシア、フィリピン、ポーランド、ルーマニア、ロシア、南アフリカ、韓国、ウクライナ、台湾、タイ
用法及び用量
通常、成人にはサリルマブ(遺伝子組換え)として1回200mgを2週間隔で皮下投与する。なお、患者の状態により1回150mgに減量すること。
本邦における関節リウマチに対するメトトレキサートの
用法及び用量
通常、1週間単位の投与量をメトトレキサートとして6mgとし、1週間単位の投与量を1回又は2〜3回に分割して経口投与する。
分割して投与する場合、初日から2日目にかけて12時間間隔で投与する。1回又は2回分割投与の場合は残りの6日間、3回分割投与の場合は残りの5日間は休薬する。これを1週間ごとに繰り返す。
なお、患者の年齢、症状、忍容性及び本剤に対する反応等に応じて適宜増減するが、1週間単位の投与量として16mgを超えないようにする。
(1)ACR20改善率(24週時)[主要評価項目]
24週時におけるACR20改善率は、ケブザラ2用量群のいずれにおいてもプラセボ+MTX群に対して優越性が検証され、ケブザラ150mg+MTX群で58%、ケブザラ200mg+MTX群で66%であった。
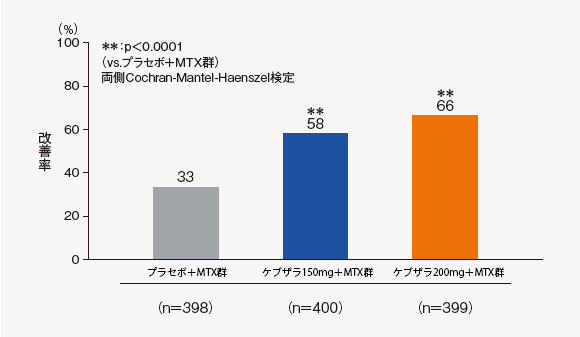
中止(救済治療を含む)など判定不能な患者について、それ以降の時点には効果不十分症例として補完した。
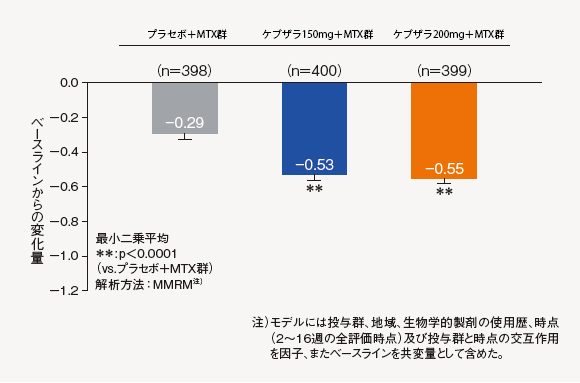
(2)HAQ-DI変化量(16週時)[主要評価項目]
16週時におけるべースラインからのHAQ-DI変化量は、ケブザラ2用量群のいずれにおいても-0.5以上の低下を示し、プラセボ+MTX群に対して優越性が検証された。
(3)Major Clinical Response ※(52週時)[副次評価項目]
※52週間の期間中において24週間以上連続してACR70が持続していることと定義
Major Clinical Responseを達成した患者の割合は、ケブザラ2用量群のいずれにおいてもプラセポ+MTX群に対して有意差が認められた。
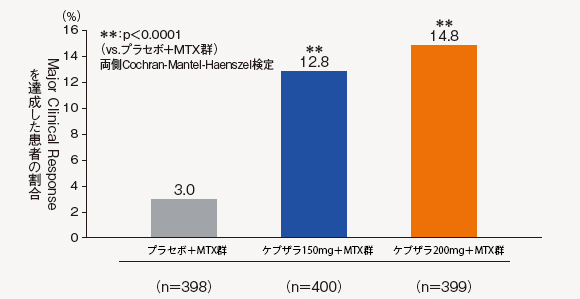
中止(救済治療を含む)など判定不能な患者について、それ以降の時点には効果不十分症例として補完した。
参考情報
■関節破壊に及ぼす影響
52週時におけるベースラインからのmTSS変化量は、プラセボ+MTX群に対してケブザラ2用量群のいずれにおいても優越性が検証された。
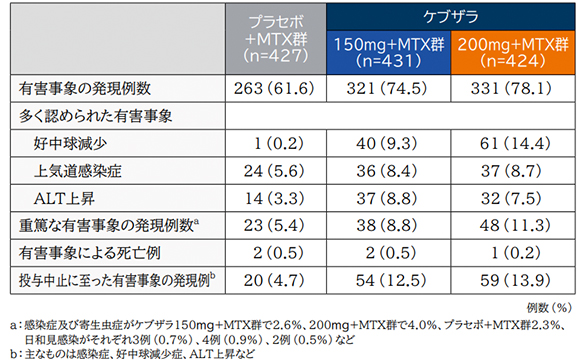
(4)安全性
有害事象の発現率は、ケブザラ150mg+MTX群で74.5%(321/431例)、200mg+MTX群で78.1%(331/424例)、プラセボ+MTX群で61.6%(263/427例)であった。
多く認められた有害事象は、好中球減少がそれぞれ9.3%(40/431例)、14.4%(61/424例)、0.2%(1/427例)、次いで上気道感染症がそれぞれ8.4%(36/431例)、8.7%(37/424例)、5.6%(24/427例)、ALT上昇がそれぞれ8.6%(37/431例)、7.5%(32/424例)、3.3%(14/427例)であった。
重篤な有害事象はケブザラ150mg+MTX群で8.8%(38/431例)200mg+MTX群で11.3%(48/424例)、プラセボ+MTX群で5.4%(23/427例)に認められた。最も多く認められたものは感染症及び寄生虫症(ケブザラ150mg+MTX群で2.6%、200mg+MTX群で4.0%、プラセボ+MTX群で2.3%)であり、日和見感染がそれぞれ0.7%(3/431例)、0.9%(4/424例)、0.5%(2/427例)に認められた。
投与中止に至った有害事象は、ケブザラ150mg+MTX群で12.5%(54/431例)、200mg+MTX群で13.9%(59/424例)、プラセボ+MTX群で4.7%(20/427例)に認められ、主なものは感染症、好中球減少症及びALT上昇であった。
死亡例はケブザラ150mg+MTX群で2例、200mg+MTX群で1例、プラセボ+MTX群で2例に認められた。
社内資料:海外第Ⅲ相プラセボ対象二重盲検比較試験(メトトレキサート併用試験)[EFC11072 試験 Part B](承認時評価資料)
Genovese MC et al.Arthritis Rheumatol 2015;67(6):1424-1437
本試験はSanofiの出資により実施された。
Copyright 2015 Wiley. Used with permission from Genovese MC,Sarilumab Plus Methotrexate in Patients With Active Rheumatoid Arthritis and Inadequate Response to Methotrexate Results of a Phase Ⅲ Study.Arthritis Rheumatol,Wiley Periodicals,Inc






























