骨代謝マーカーへの影響(TOWER試験)
目次
「禁忌を含む使用上の注意」等は添付文書をご参照ください。
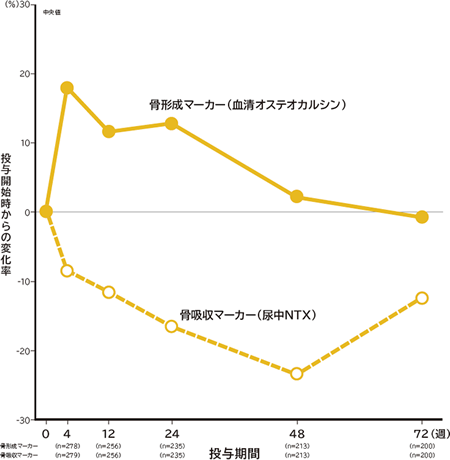
骨代謝マーカー変化率(テリボン群)
テリボン群は、骨吸収を亢進させることなく骨形成を促進することが示唆されました。
骨代謝マーカー変化率(テリボン群)
第Ⅲ相骨折試験(TOWER試験)
その他評価項目
その他評価項目
安全性
副作用は、テリボン群43.8%(127/290例)、プラセボ群18.1%(52/288例)に認められた。主な副作用は、テリボン群で悪心54例(18.6%)、嘔吐25例(8.6%)、頭痛22例(7.6%)であり、プラセボ群でめまい6例(2.1%)、血中アルカリホスファターゼ増加6例(2.1%)、嘔吐5例(1.7%)であった。また、重篤な副作用は、テリボン群で発疹1例、消化不良・意識消失1例であった。重篤以外の投与中止に至った副作用は、テリボン群で36例(12.4%)、プラセボ群で4例(1.4%)が認められ、その主なものは、テリボン群では悪心16例、倦怠感7例、嘔吐6例、プラセボ群では食欲減退2例であった。
第Ⅲ相骨折試験(TOWER試験)の概要
| 目的 | 骨折の危険性の高い原発性骨粗鬆症患者の骨折抑制におけるテリボン56.5μg製剤の有効性について検討する。 |
|---|---|
| 対象 |
65歳以上の骨折の危険性の高い原発性骨粗鬆症外来患者※1578例 (テリボン群290例、プラセボ群288例) ※1 日本骨代謝学会の「原発性骨粗鬆症の診断基準(2000年度改訂版)」により診断し、脊椎既存骨折が1個以上5個以下、骨密度がYAM80%未満を全て満たす患者を対象とした。 |
| 試験デザイン | 多施設共同、無作為化、二重盲検、プラセボ対照、並行群間比較試験 |
| 投与方法 |
テリボン56.5μg製剤またはプラセボを1週間に1回72週間皮下投与した。 なお、基礎薬剤として、両群ともにカルシウム配合剤※2を併用した。 ※2 1日当たりの投与量としてカルシウム610mg、ビタミンD3400IUおよびマグネシウム30mg。 |
| 投与期間 | 72週間 |
| 評価項目 |
|
| 解析計画 | 主要評価項目の主たる解析として、新規椎体骨折について、Kaplan-Meier法に基づく72週後の骨折発生率を算出するとともに、log-rank検定を行いプラセボ群に対する優越性を検証した(有意水準:両側10%、信頼区間:両側90%)。 骨折以外の副次的またはその他の評価項目は治療開始時からの経時的変化の要約分析を行った(有意水準:両側5%、信頼区間:両側95%)。 |
承認時評価資料, 社内資料:骨折リスクの高い原発性骨粗鬆症に対するMN-10-Tの第Ⅲ相骨折試験
Nakamura T et al. J Clin Endocrinol Metab. 2012;97(9):3097-3106.
本試験は旭化成ファーマ株式会社の支援により実施された。
閲覧履歴
お問い合わせ(本社)































