- リコモジュリン®トップ
- セミナー・講演会
- リコモジュリン投与量計算ツール
- リコモジュリン®について
- 資料ライブラリ
- 日本血栓止血学会DIC診療ガイドライン2024
- 日本血栓止血学会DIC診療ガイドライン2024 Web講演会記録集
- リコモジュリンの薬理作用、薬物動態に関する説明動画
- JDDW2022記録集
- 消化器領域における血小板減少をおこす疾患特性と臨床成績に関する資料
- リコモジュリン®製品詳細
- リコモジュリン®トップ
- セミナー・講演会
- リコモジュリン Utility tools
- リコモジュリンについて
- 資料ライブラリ
- 日本血栓止血学会DIC診療ガイドライン2024
- 日本血栓止血学会DIC診療ガイドライン2024 Web講演会記録集
- リコモジュリンの薬理作用、薬物動態に関する説明動画
- JDDW2022記録集
- 消化器領域における血小板減少をおこす疾患特性と臨床成績に関する資料
臨床試験成績
① 第III相臨床試験(ヘパリンナトリウムを対照薬とした二重盲検比較試験)
| 対象 | 旧厚生省DIC診断基準*に基づきDICと診断された(DICの基礎疾患が造血器悪性腫瘍あるいは感染症の)入院患者 |
|---|---|
| 投与量・投与方法 |
リコモジュリン群:380U/kg、1日1回30分静脈内持続投与 ヘパリン群:8U/kg/hr、24時間静脈内持続投与 ダブルダミー法 |
| 投与期間 | 6日間 |
| 主要評価項目 | DIC離脱率(非劣性の検証) |
| 副次的評価項目 | 出血症状の経過、転帰、凝血学的検査値改善度 等 |
| 評価・観察期間 |
投与開始後7日目: DIC離脱率、出血症状の経過、凝血学的検査値改善度 投与開始後14日目まで: 有害事象 投与開始後28日目: 転帰 投与開始後28日目まで: 重篤な有害事象 |
| 症例数 | 総投与症例:232例 |
| 評価対象症例 |
DIC離脱率:224例、出血症状の経過及び転帰:227例 凝血学的検査値改善度:208例、安全性:231例 |
| 解析計画 |
DIC離脱率:基礎疾患別に投与開始7日目のDIC離脱率を算出し、基礎疾患-薬剤間の質的交互作用がないことを確認する。その後、Woolson-Beanの方法により、層調整済みのDIC離脱率の群間差および両側95%信頼区間を算出する。DIC離脱率の群間差について下側95%信頼限界が-5%を上回ったとき、非劣性が検証されたと判断することとし、下側95%信頼限界が0%を上回ったときには、優越性が示されたと判断する。 出血症状の経過:投与開始7日目(または中止時)の出血症状の経過に関して、DICの基礎疾患で層調整した拡張Mantel検定を行う。有意水準は両側5%とする。同時に、Woolson-Beanの方法により調整した改善率の差の両側95%信頼区間を算出する。 転帰:投与開始7日目および投与開始後28日目の生存率に関して、基礎疾患で調整したMantel-Haenszel検定を実施する。有意水準は両側5%とする。 凝血学的検査値:最終評価時点の変化量または変化率について、投与群間差の中央値およびその両側95%信頼区間を算出する。解析には、投与前値を共変量として考慮する。 |
*旧厚生省特定疾患血液凝固異常症調査研究班 1988年改訂
承認時評価資料,Saito H et al. J Thromb Haemost.2007;5:31-41.
本試験は旭化成ファーマ株式会社の支援により実施された。
有効性
1. 主要評価項目
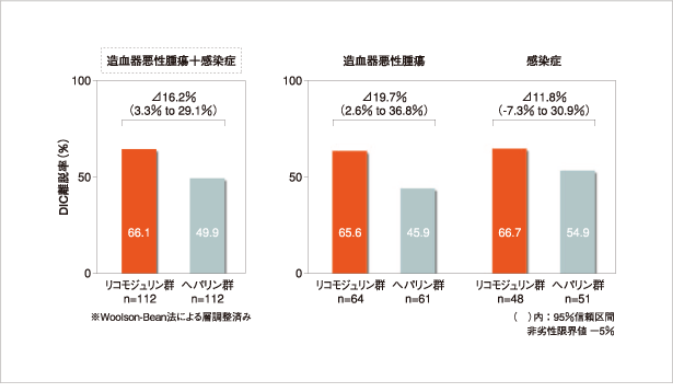
DIC離脱率(7日目)
造血器悪性腫瘍、感染症の両者を併合した解析の結果、
DIC離脱率において、ヘパリン群に対する非劣性が検証された。
また、群間差の下側95%信頼限界が0%を上回ったため優越性が示された。
2. 副次的評価項目
(1)出血症状の経過
出血症状の消失率はリコモジュリン群で35.2%であった。
基礎疾患別に解析すると消失率は、造血器悪性腫瘍では32.6%、感染症では37.8%であった。
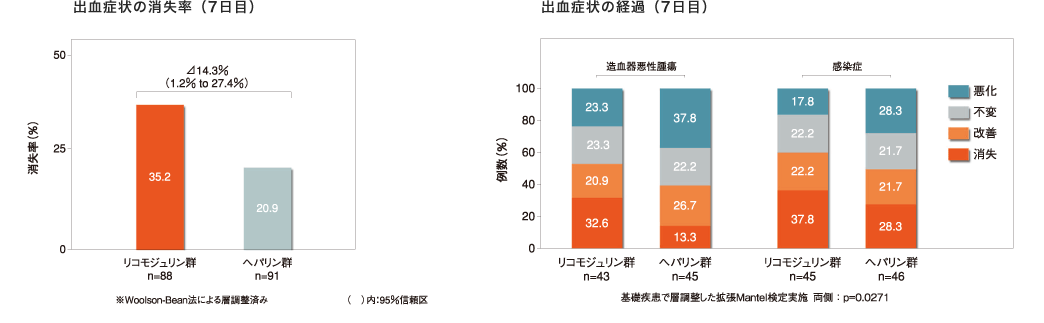
出血症状の経過
投与開始から7日目(又は中止時)における症状の経過を、各症状の程度を投与前のものと総合的に比較・判断して、その推移から以下の基準に従って6段階で評価した。
- 1.消失;
- 認められた唯一あるいは全ての症状の程度が-となった場合
- 2.改善;
- 認められた唯一の症状の程度が改善した場合、あるいは複数の症状の程度で改善又は-となったものの数の合計が、症状の程度が悪化又は新たに発生した症状の数の合計を上回ると判断される場合
- 3.不変;
- 認められた唯一の症状の程度が不変の場合、あるいは複数の症状の程度で改善又は-となったものの数の合計が、症状の程度が悪化又は新たに発生した症状の数の合計と同数と判断される場合
- 4.悪化;
- 認められた唯一の症状の程度が悪化した場合、あるいは複数の症状の程度で改善又は-となったものの数の合計が、症状の程度が悪化又は新たに発生した症状の数の合計を下回ると判断される場合
- 5.初めから症状なし;
- 症状が認められない場合
- 6.判定不能
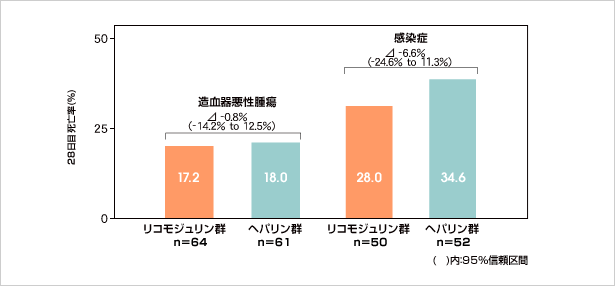
(2)28日目転帰
リコモジュリン群の投与開始後28日目の死亡率は、造血器悪性腫瘍では17.2%(11/64例)であり、感染症では28.0%(14/50例)であった。
なお、投与開始後7日目までの期間の死亡例は、造血器悪性腫瘍では2例、感染症では5例であった。
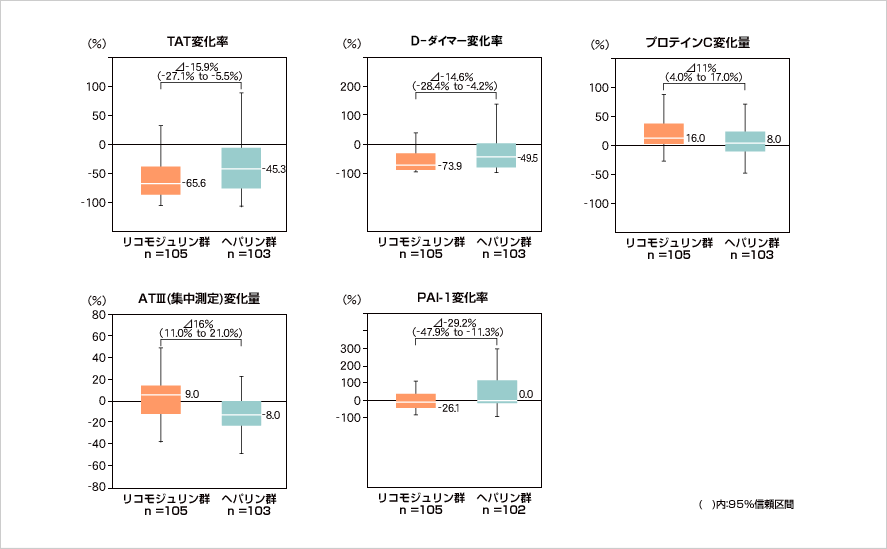
(3)凝血学的検査値に対する効果
凝血学的検査値(TAT、D-ダイマー、プロテインC、ATⅢ、PAI-1)は、リコモジュリン投与後改善する方向へ変動した。
安全性
1. 出血症状に関連する有害事象
リコモジュリン群の出血症状に関連する有害事象の発現率(7日目)は43.1%(50/116例)であった。
| 投与群 | 発現症例数(%) |
|---|---|
|
リコモジュリン群(n=116) ヘパリン群(n=115) |
50(43.1%) 65(56.5%) |
2. 副作用
副作用発現率はリコモジュリン群で23.3%(27/116例)、ヘパリン群で25.2%(29/115例)であった。
重篤な副作用は、リコモジュリン群に1件(肺出血)、ヘパリン群に6件(脳出血、頭蓋内出血、カテーテル留置部位出血、骨髄穿刺部位出血、脳血管障害、腎機能異常が各1件)認められた。
副作用による死亡は、ヘパリン群の1例(死因:脳出血)であった。
投与中止に至った副作用は、リコモジュリン群では0件で、ヘパリン群に14件[紫斑、脳出血、筋肉内出血、頭蓋内出血、骨髄穿刺部位出血、黄疸、血清AST(GOT)上昇、血清ALT(GPT)上昇、ビリルビン血症、LDH上昇、DIC、疼痛 各1件、カテーテル留置部位出血2件]認められた。
副作用
| リコモジュリン群(n=116) | ヘパリン群(n=115) | ||
|---|---|---|---|
| 発現症例数(%) | 27(23.3%) | 29(25.2%) | |
| 主な副作用 | カテーテル留置部位出血 | 7(6.0%) | 7(6.1%) |
| 血清AST(GOT)上昇 | 7(6.0%) | 4(3.5%) | |
| 血清ALT(GPT)上昇 | 6(5.2%) | 4(3.5%) | |
| 紫斑(病) | 4(3.4%) | 6(5.2%) | |
| 貧血 | 1(0.9%) | 6(5.2%) | |































 DIC領域情報
DIC領域情報