- プラケニル®トップ
- セミナー・講演会
- プラケニル®について
- SLEについて
- 評価指標(表計算)
- 実践的SLE診療の How to ~ 患者コミュニケーションから紐解く
- 症例からみるSLEの初診から確定診断までの経過
- エキスパートからのメッセージ
- Lupus Research Outlook Today
- 資料ライブラリ
- Web講演会記録集
- Lupus Expert’s View 2021 ~長期予後を考えたSLE診療~
- プラケニル座談会
- EULAR recommendations 2023
- SLE・プラケニル患者説明動画
- プラケニル製品詳細
- プラケニル®トップ
- セミナー・講演会
- プラケニル®について
- SLEについて
- 評価指標(表計算)
- 実践的SLE診療の How to ~ 患者コミュニケーションから紐解く
- 症例からみるSLEの初診から確定診断までの経過
- エキスパートからのメッセージ
- Lupus Research Outlook Today
- 資料ライブラリ
- Web講演会記録集
- Lupus Expert’s View 2021 ~長期予後を考えたSLE診療~
- プラケニル座談会
- EULAR recommendations 2023
- SLE・プラケニル患者説明動画
第Ⅲ相試験(安全性)
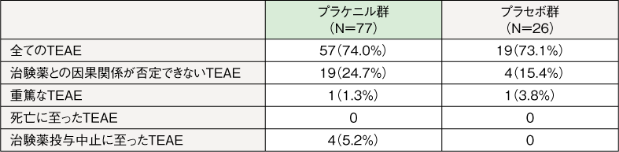
【治験薬投与後16週までの二重盲検期における安全性】
治験薬投与後16週までの二重盲検期に認められたTEAEのうち、治験薬との因果関係
が否定できないTEAE(副作用)の発現率は、プラケニル群24.7%(19/77例)、プラセボ群15.4%(4/26例)であり、主なTEAE(副作用)〔発現率5%以上〕はプラケニル群で下痢6例(7.8%)であった。
重篤なTEAEはプラケニル群で薬疹1例(1.3%)、プラセボ群でウイルス性上気道感染1例(3.8%)が認められた。なお、ウイルス性上気道感染は治験薬との因果関係が否定された。
治験薬投与中止に至ったTEAEはプラケニル群で4例(5.2%)に認められ、薬疹、中毒性皮疹、全身性皮疹、皮膚エリテマトーデスが各1例(1.3%)であった。なお、皮膚エリテマトーデスは治験薬との因果関係が否定された。死亡に至ったTEAEは認められなかった。
TEAE:treatment-emergent adverse event;治験薬を最初に投与した後に発現または悪化した有害事象
例数(%):TEAEが1件以上発現した患者
【治験薬投与後55週までの全期間における安全性】
治験薬投与後55週までの全期間に認められたTEAEのうち、治験薬との因果関係が否定できないTEAE(副作用)の発現率は、プラケニル/プラケニル群32.5%(25/77例)、プラセボ/プラケニル群34.6%(9/26例)であり、主なTEAE(副作用)〔発現率5%以上〕はプラケニル/プラケニル群で下痢8例(10.4%)、プラセボ/プラケニル群で下痢2例(7.7%)であった。
重篤なTEAEはプラケニル/プラケニル群で8例(10.4%)、プラセボ/プラケニル群で3例(11.5%)に認められ、そのうち治験薬との因果関係が否定できない事象はプラケニル/プラケニル群で蜂巣炎、肝機能異常、薬疹が各1例(1.3%)、プラセボ/プラケニル群で皮膚粘膜眼症候群(Stevens-Johnson症候群)1例(3.8%)であった。
治験薬投与中止に至ったTEAEはプラケニル/プラケニル群で6例(7.8%)、プラセボ/プラケニル群で2例(7.7%)に認められ、プラケニル/プラケニル群が薬疹、中毒性皮疹、全身性皮疹、皮膚エリテマトーデス、肺炎球菌性髄膜炎、肝機能異常各1例(1.3%)、プラセボ/プラケニル群が中毒性皮疹と皮膚粘膜眼症候群(Stevens-Johnson 症候群)各1例(3.8%)であった。なお、プラケニル/プラケニル群で発現した肺炎球菌性髄膜炎と皮膚エリテマトーデスは治験薬との因果関係が否定された。死亡に至ったTEAEは認められなかった。
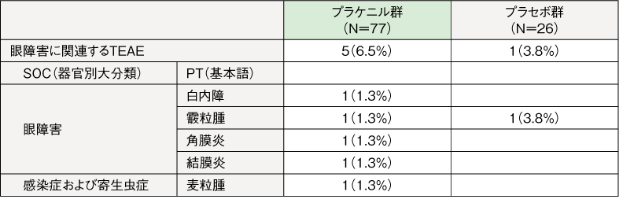
【眼障害に関連する有害事象】
治験薬投与後16週間(二重盲検期)における眼障害に関連するTEAEは、プラケニル群6.5%(5/77例)、プラセボ群3.8%(1/26例)に認められた。いずれも治験薬との因果関係は否定された。
例数(%)
治験薬投与後55週間における眼障害に関連するTEAEは、プラケニル/プラケニル群18.2%(14/77例)、プラセボ/プラケニル群15.4%(4/26例)に認められた。
プラケニル/プラケニル群において単盲検期に発現した眼乾燥、結膜炎、網脈絡膜萎縮、硝子体浮遊物の各1例については治験薬との因果関係が否定できないと判断された。
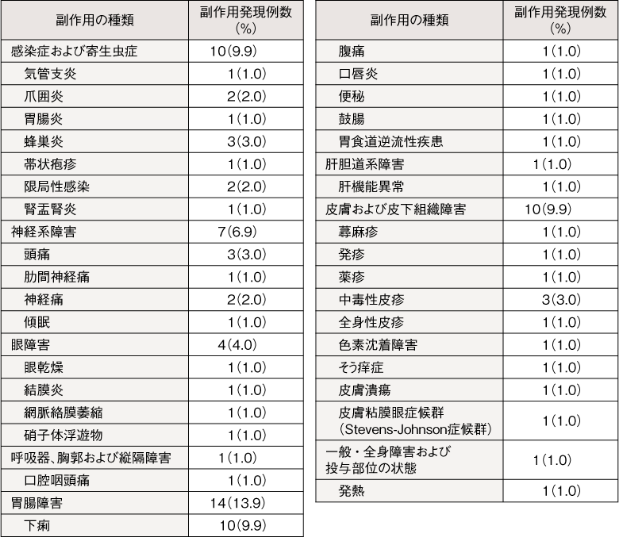
副作用(臨床検査値異常を含む)6)
国内臨床試験においてプラケニルを投与された101例中31例(30.7%)に副作用(臨床検査値異常を含む)が認められた。主な副作用は下痢10例(9.9%)、頭痛、中毒性皮疹および蜂巣炎各3例(3.0%)等であった。(承認時)

安全性解析対象集団103例のうち、投与16週および投与17週〜52週に2例が脱落した。
国際医薬品用語集日本語版(MedDRA J version 16.1)の基本語を使用し表示した。
例数(%):少なくとも1件のTEAEが発現した患者
6)承認時評価資料(国内第Ⅲ相試験)






























